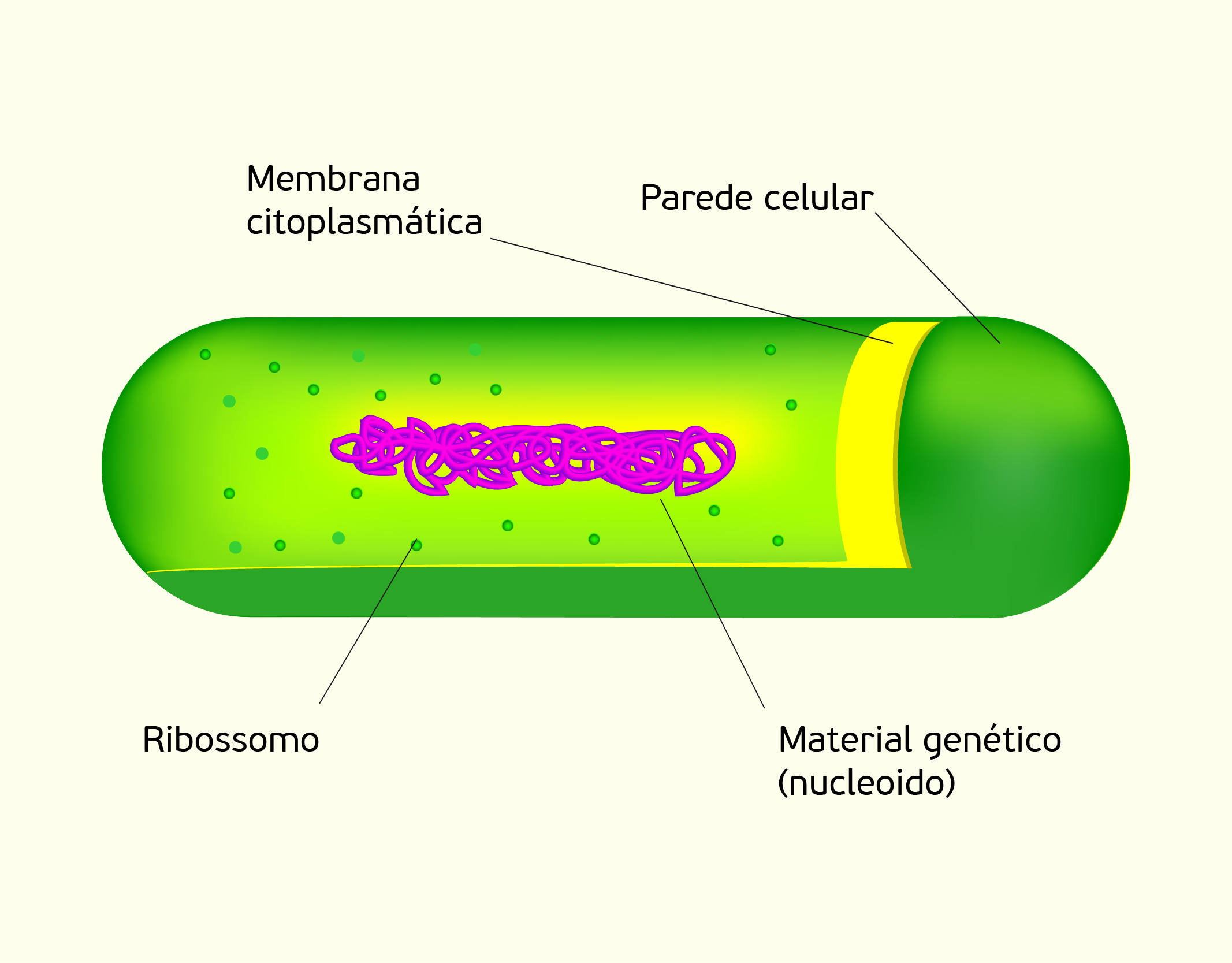
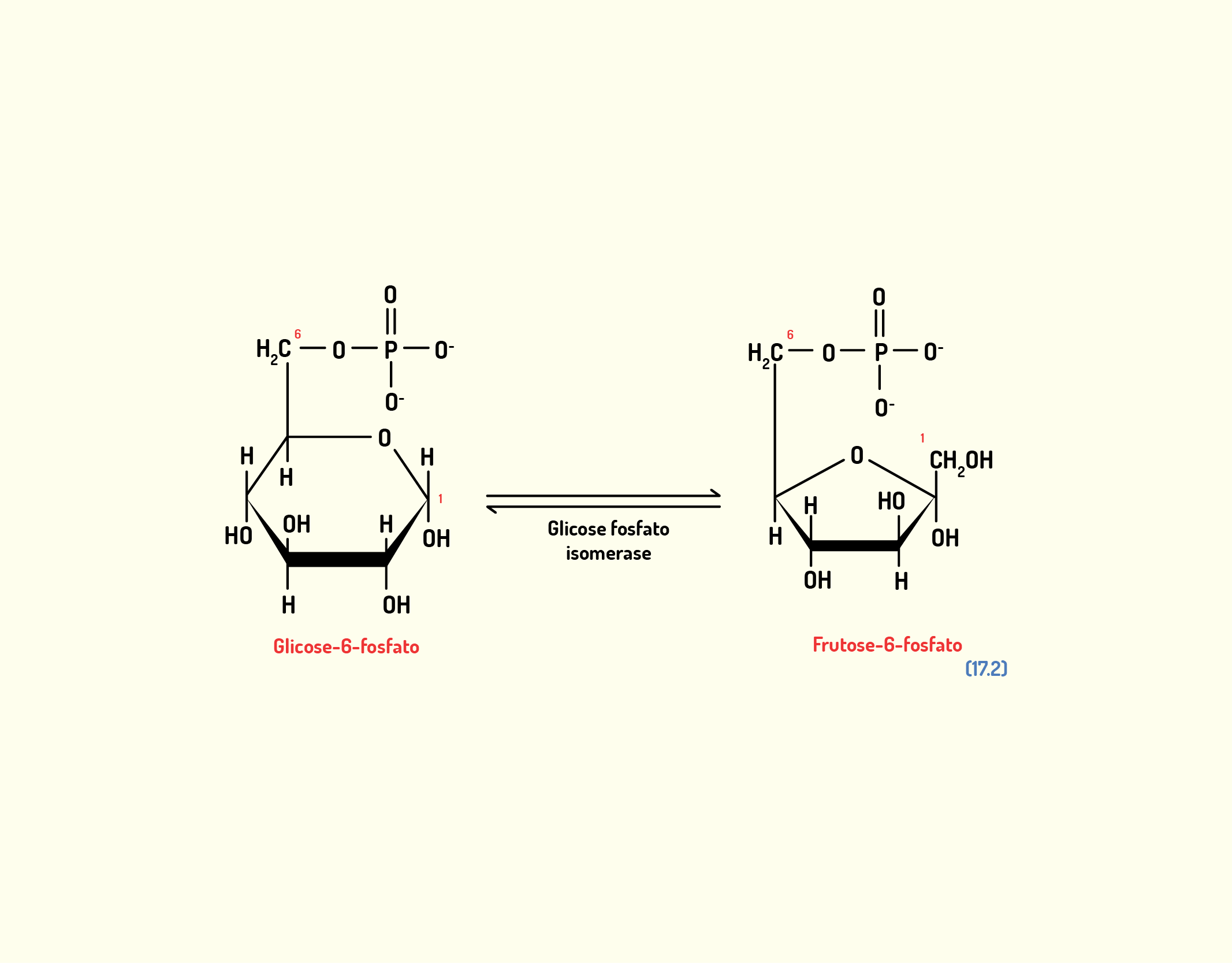
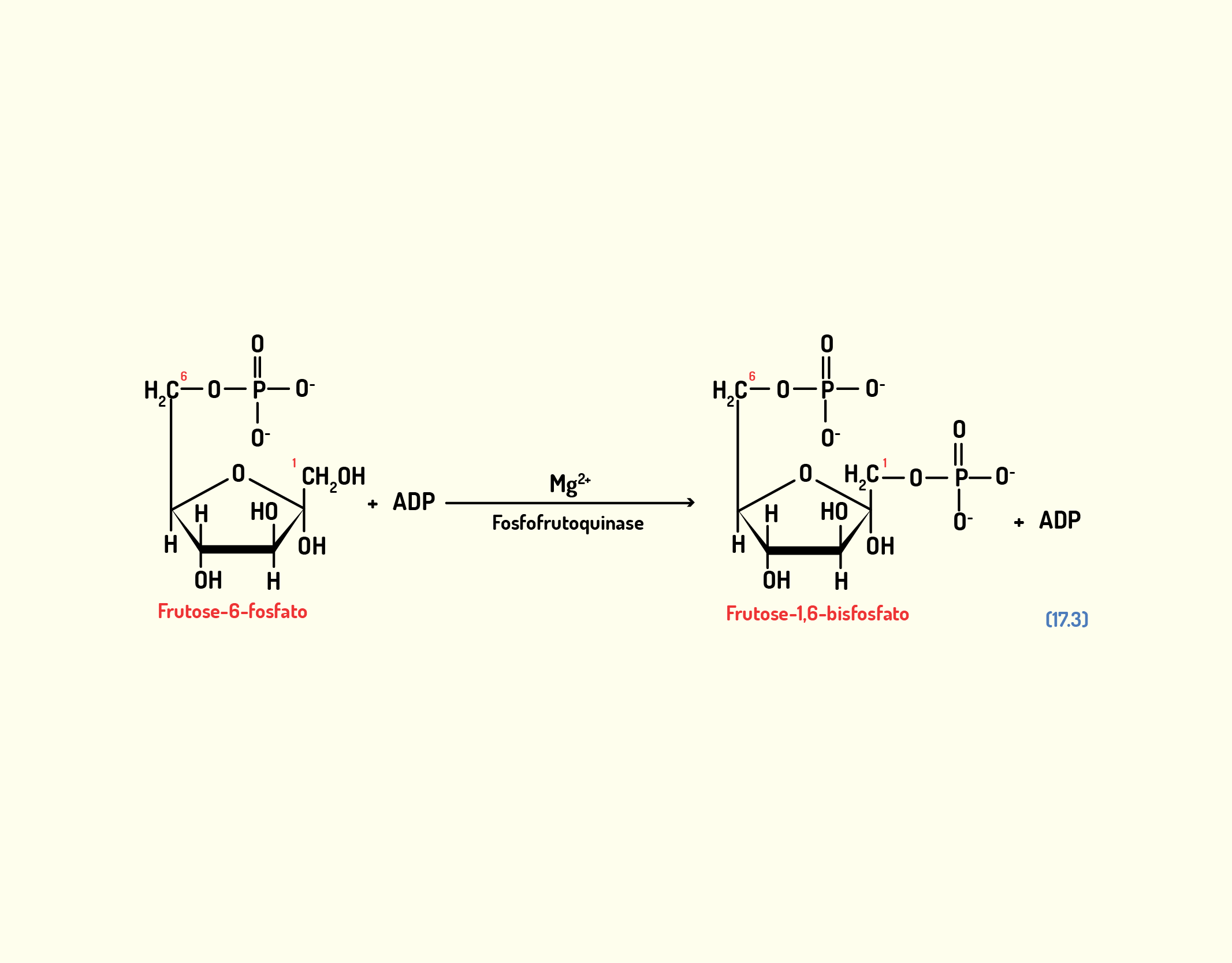
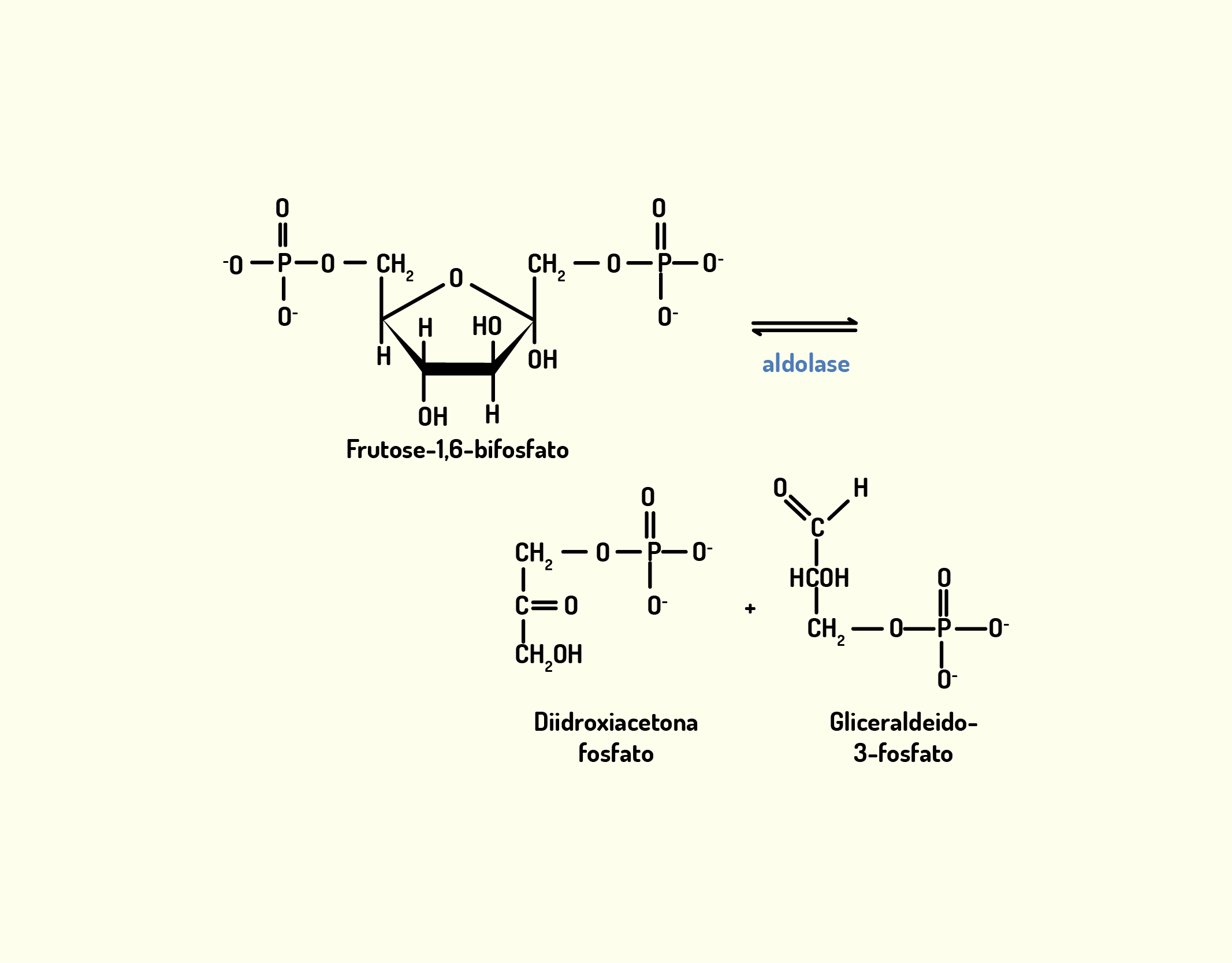
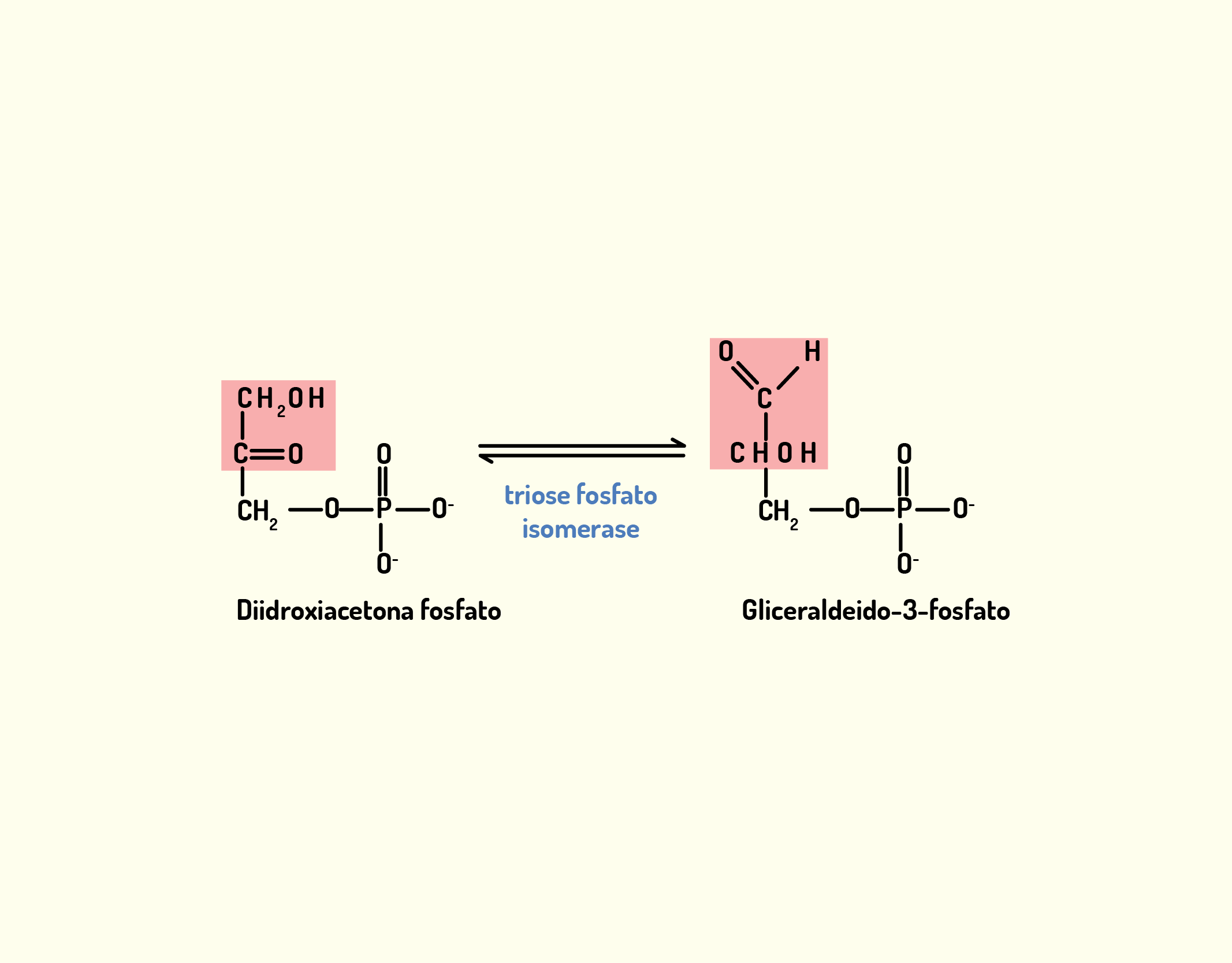
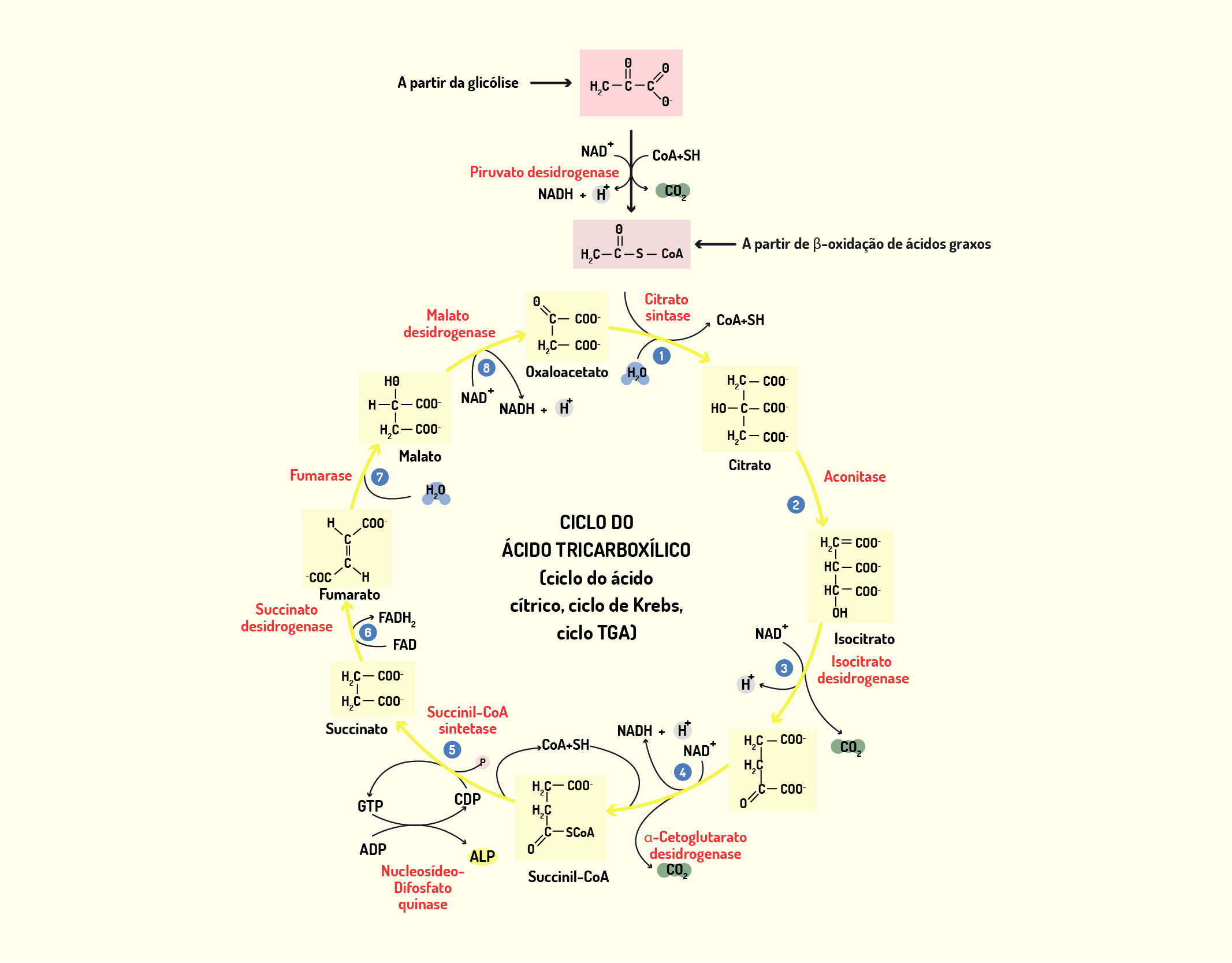
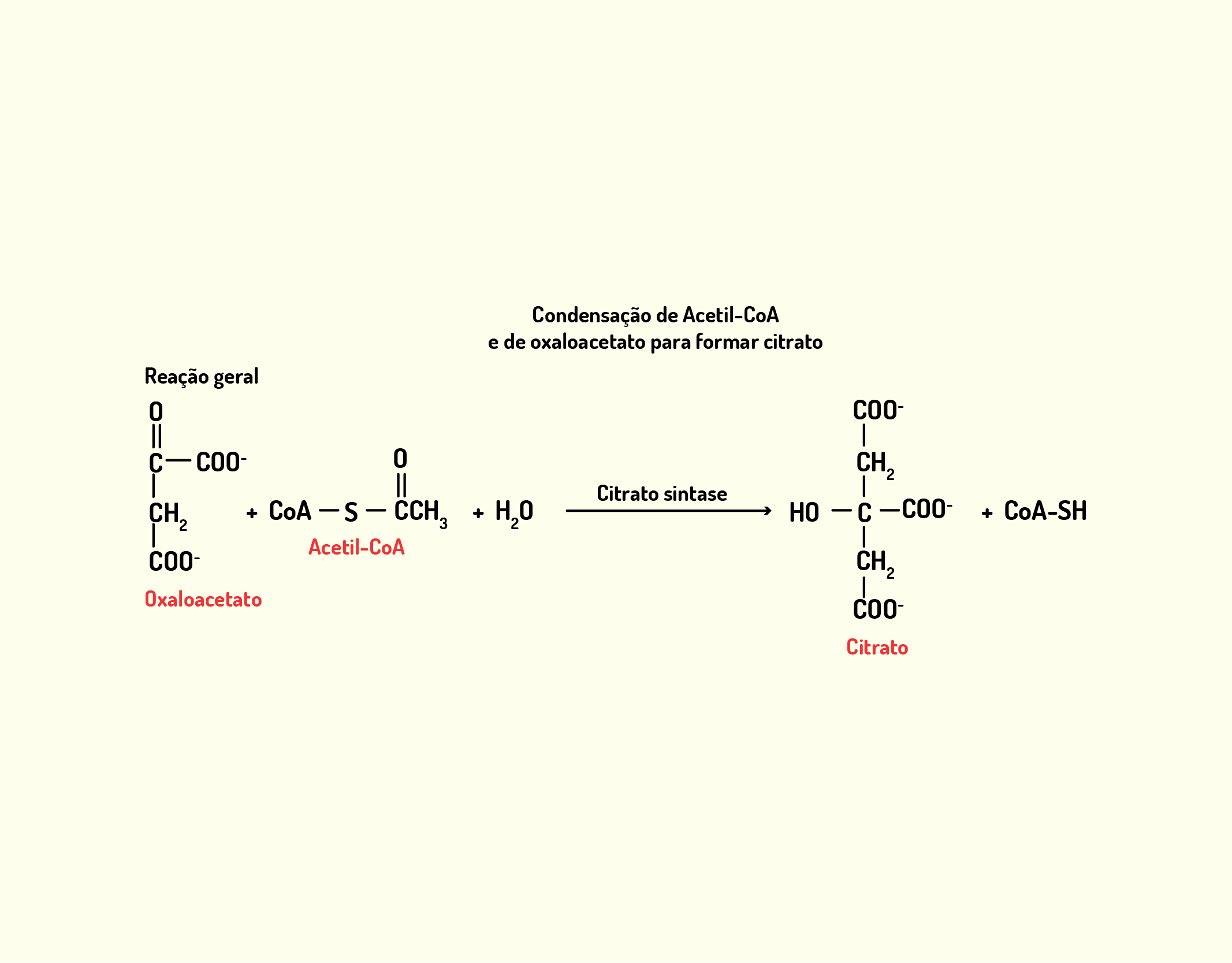
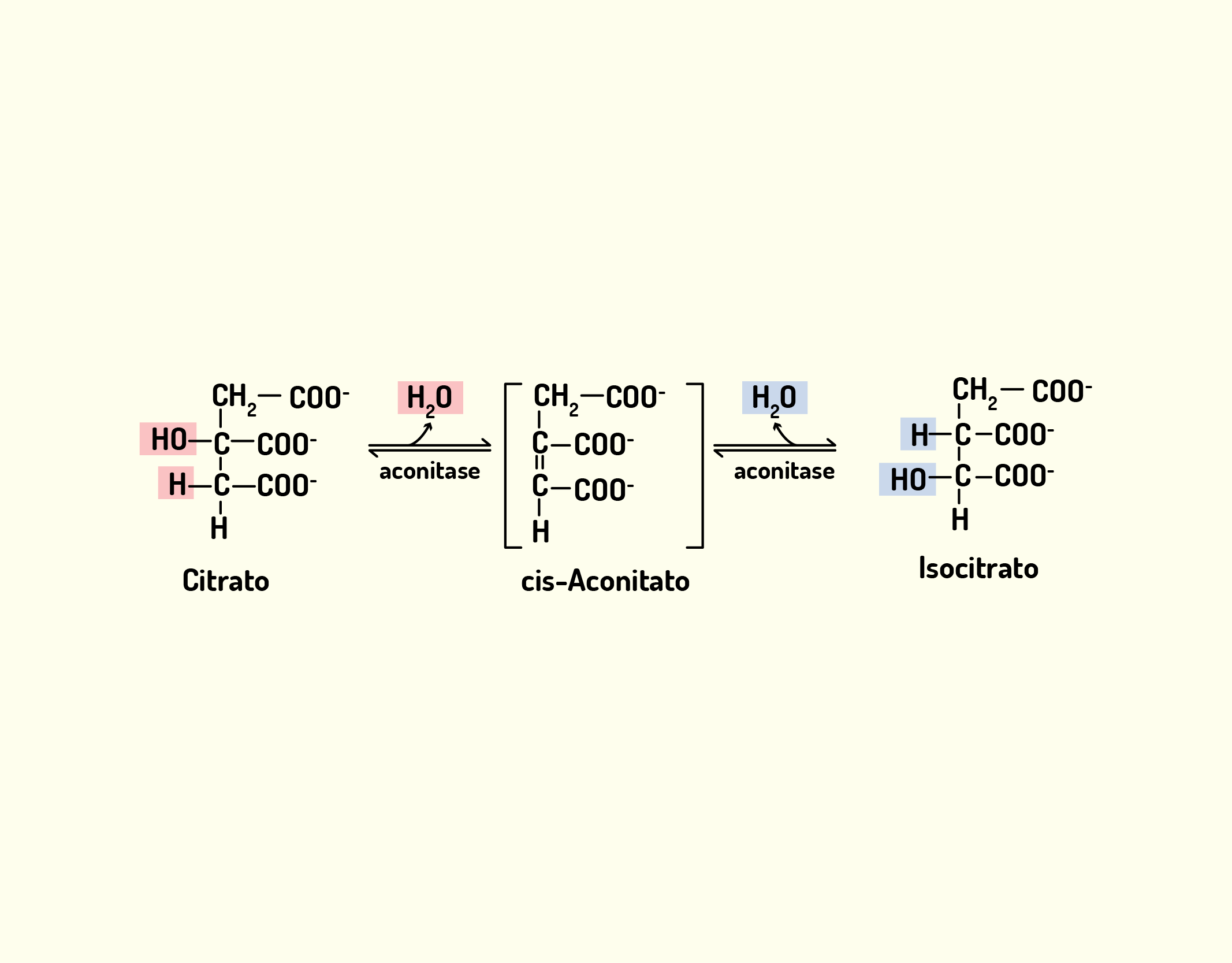
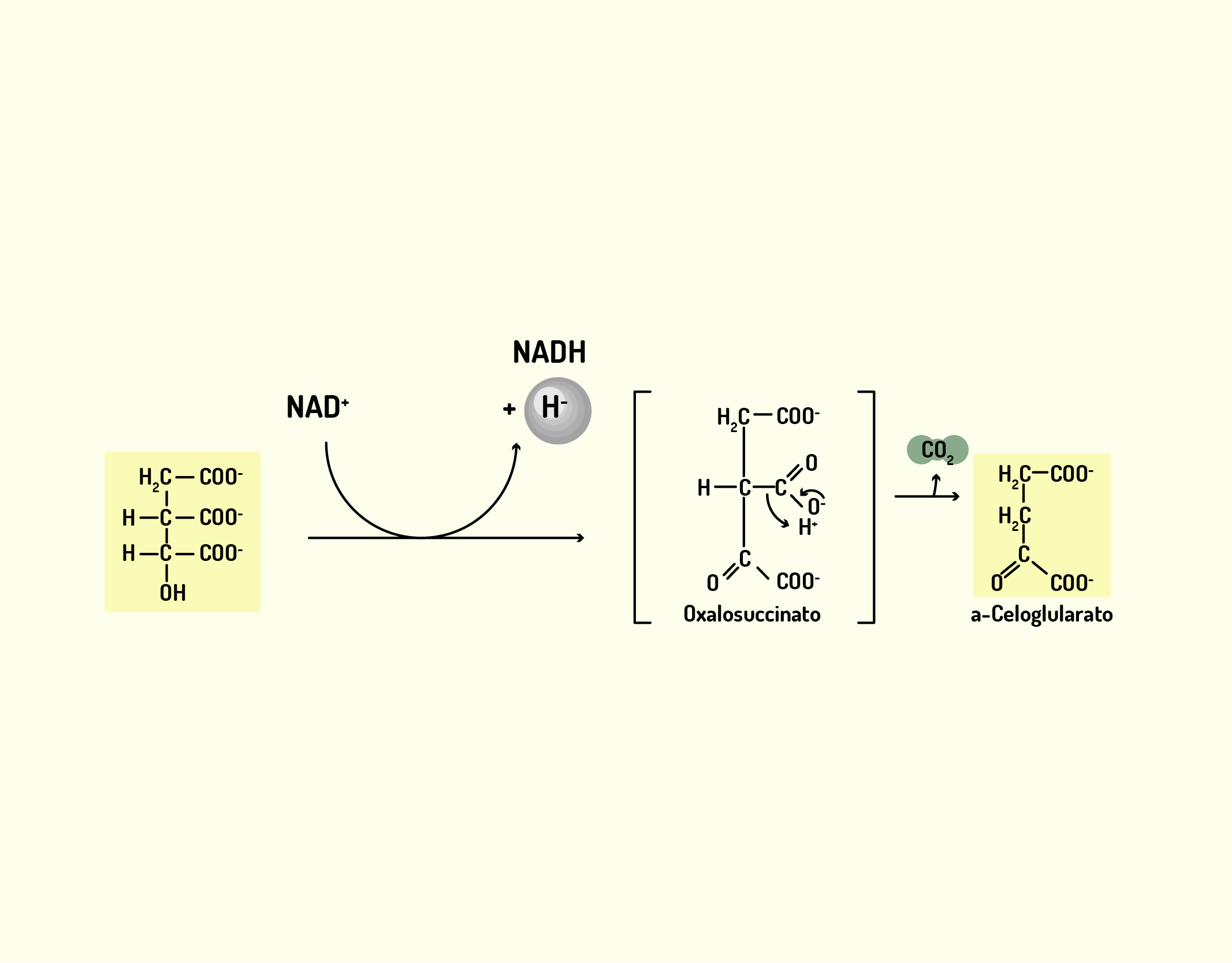
Estrutura Celular: membrana celular, núcleo e organelas
Começaremos o nosso conteúdo falando sobre a membrana celular, também chamada de membrana plasmática. A membrana celular (Figura 2.1) é uma camada composta por lipídios, proteínas e carboidratos, que delimita a célula separando o meio intracelular do meio extracelular; e nas células eucarióticas, as membranas também delimitam as organelas intracelulares. A membrana celular exerce muitas funções, além de delimitar a célula, desempenha papel de controle de entrada e saída de substâncias da célula, atuando como uma barreira com permeabilidade seletiva. Desta forma, permite a passagem de íons e moléculas específicos, impedindo a livre circulação de componentes entre os meios intracelular e extracelular (NELSON; COX, 2006; LODISH et al., 2014).
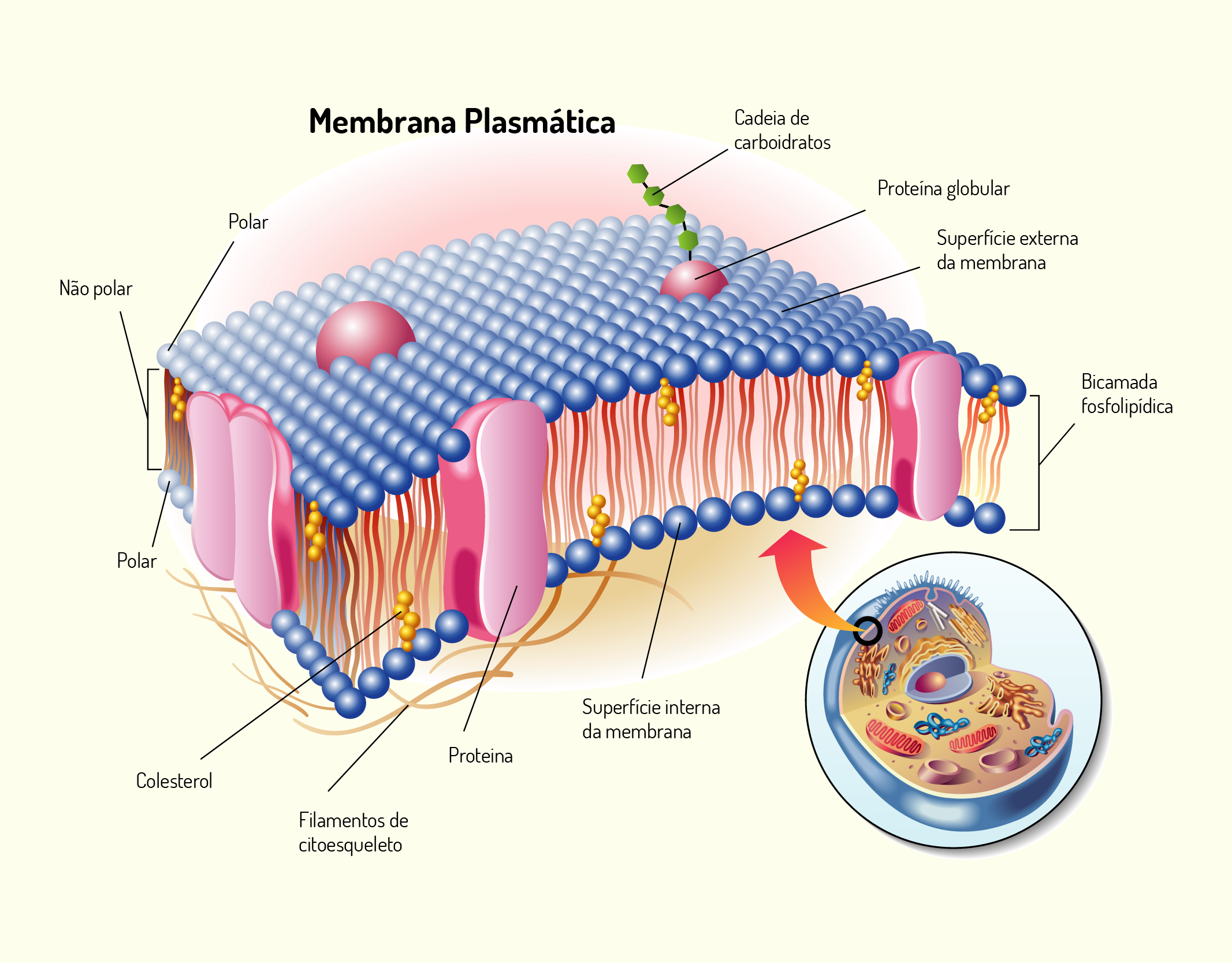
2129 Representação geral de uma membrana celular Fonte: ROBERTO BIASINI, 123RF.
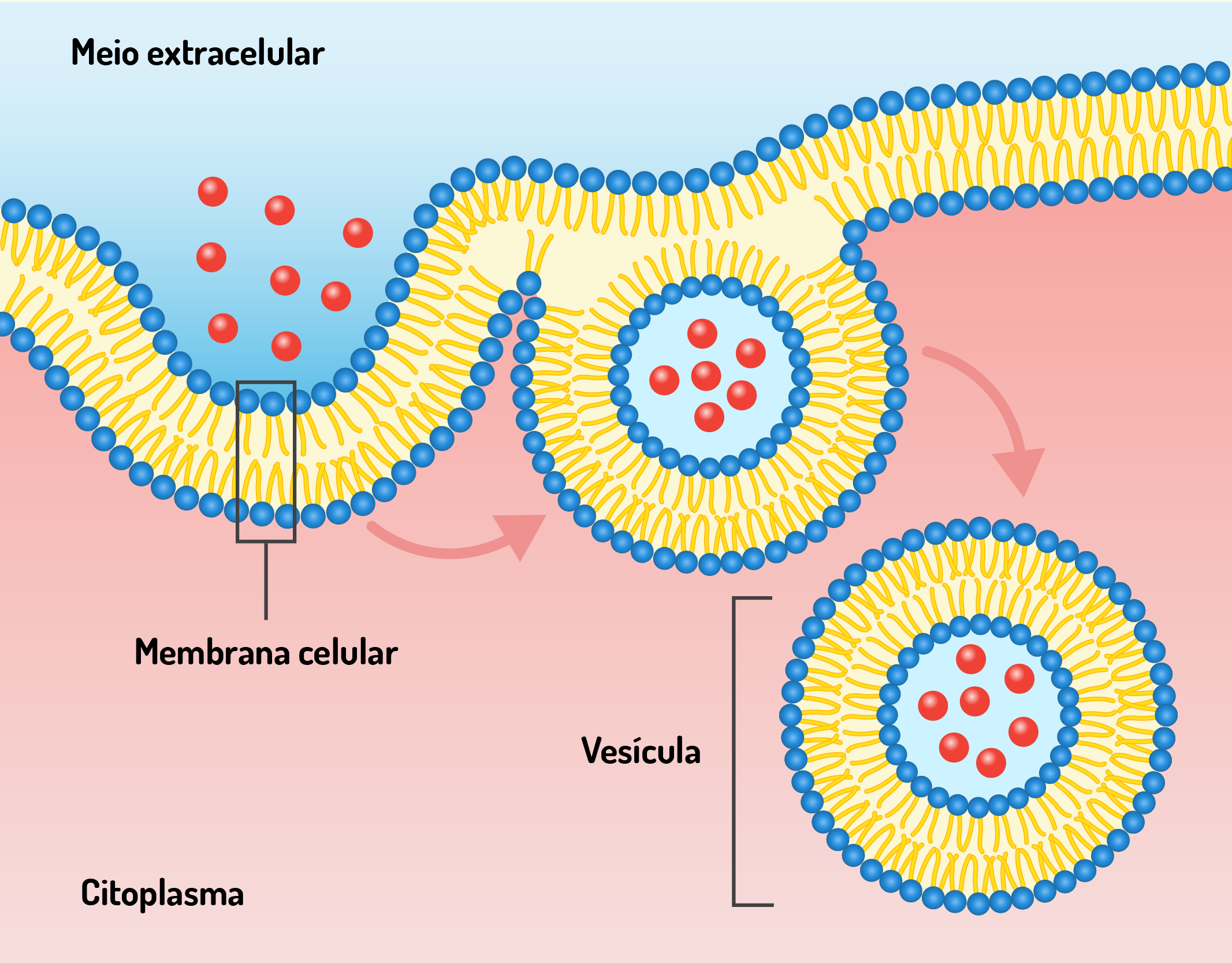
A membrana celular também participa de processos como a endocitose e exocitose. No processo de endocitose, a membrana celular sofre invaginação com o objetivo de trazer para o interior da célula substâncias à partir do meio extracelular. Já, o processo de exocitose é o inverso, a célula elimina substâncias para o meio extracelular (DE ROBERTIS; HIB, 2016).
A presença de receptores na membrana celular permite que as células reconheçam outras células e, também, moléculas como hormônios e neurotransmissores. A interação entre o receptor e uma molécula específica desencadeia respostas nas células como ajustar seu metabolismo ou padrão de expressão gênica. Além disso, a membrana também possui moléculas que promovem a aderência das células, formando camadas que delimitam compartimentos diferentes. As células procarióticas também possuem membrana, sendo esta responsável por diversas funções como transporte de membrana, sinalização celular e conexões entre as células (JUNQUEIRA; CARNEIRO, 2012; LODISH et al., 2014).
Estrutura das membranas
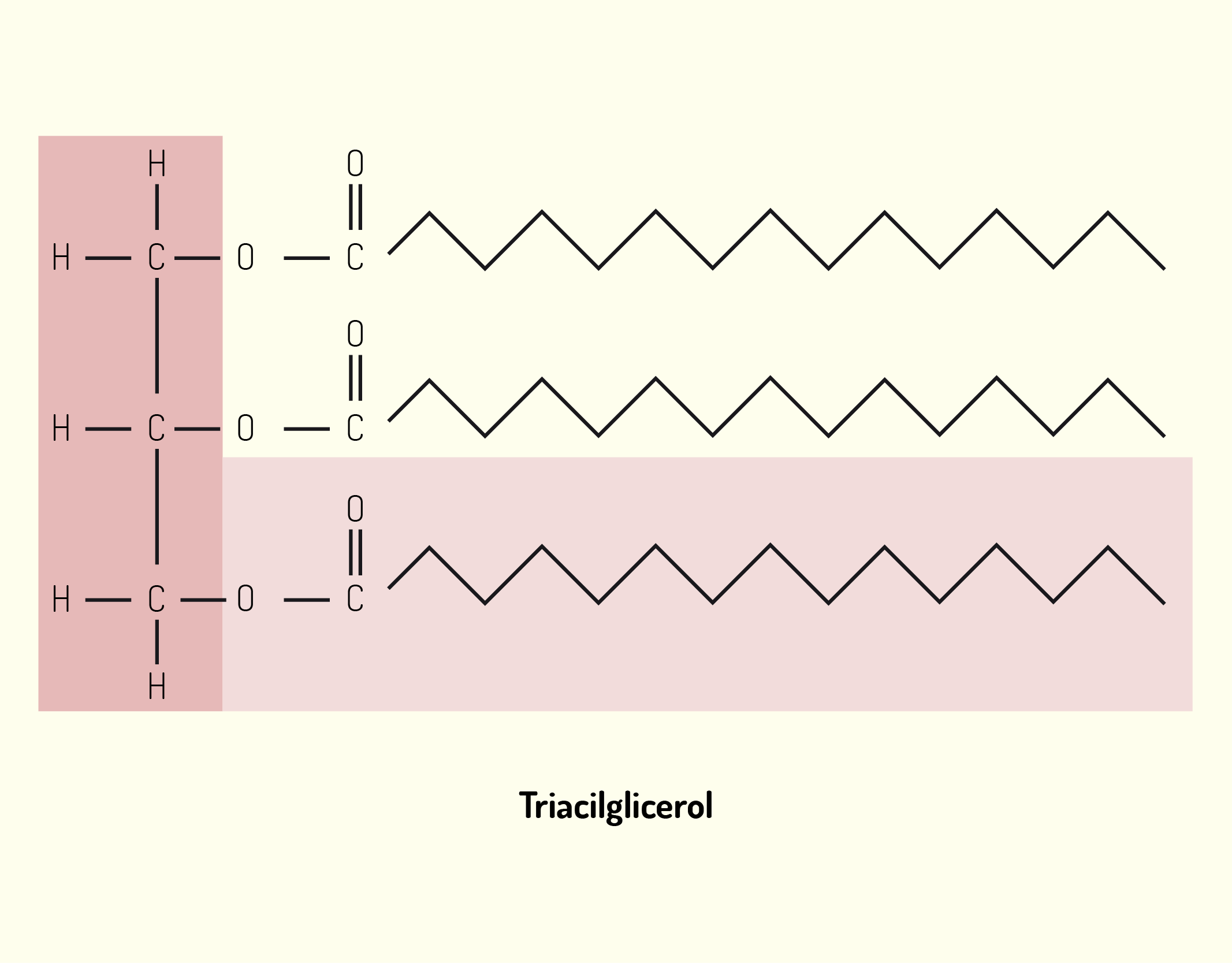
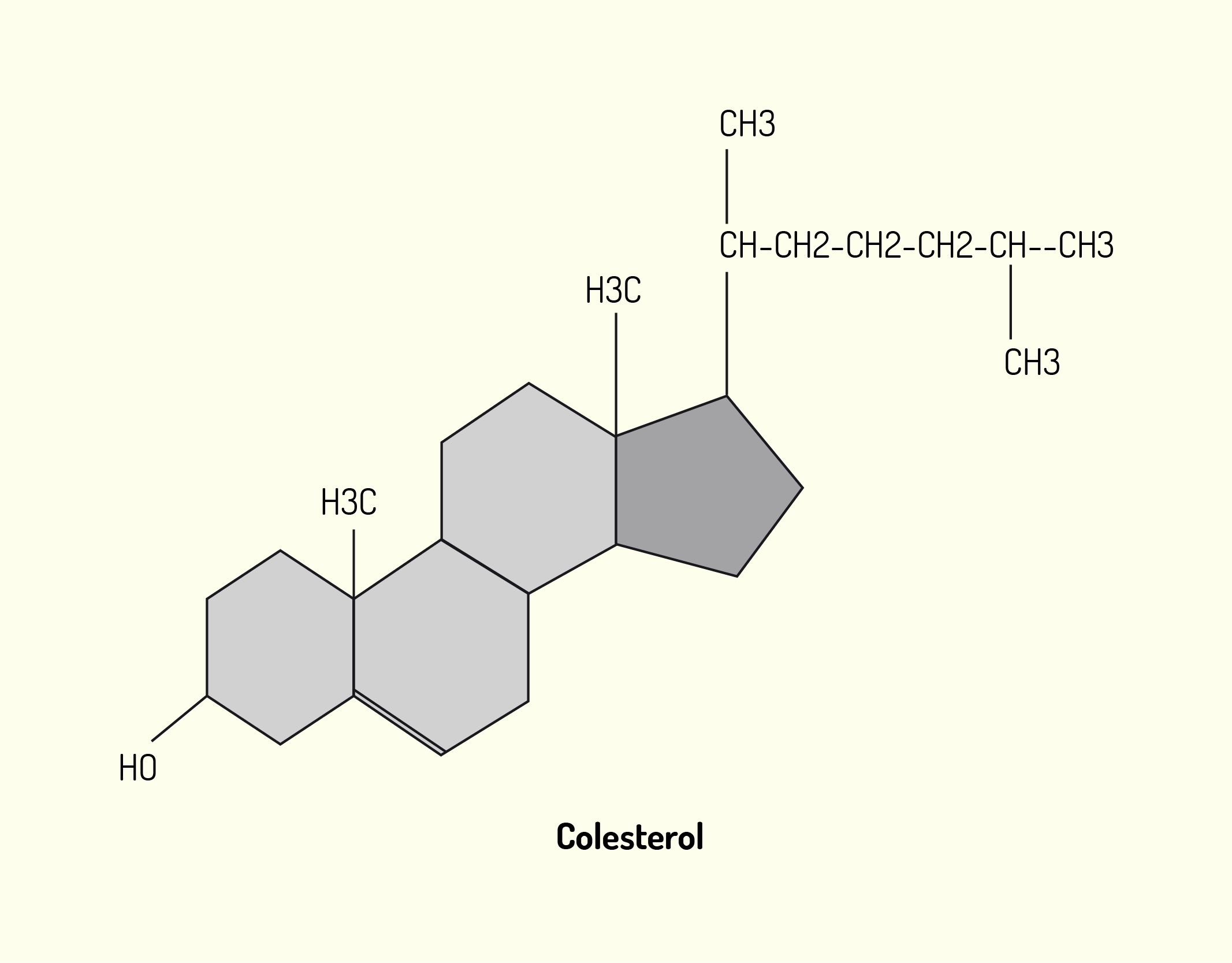
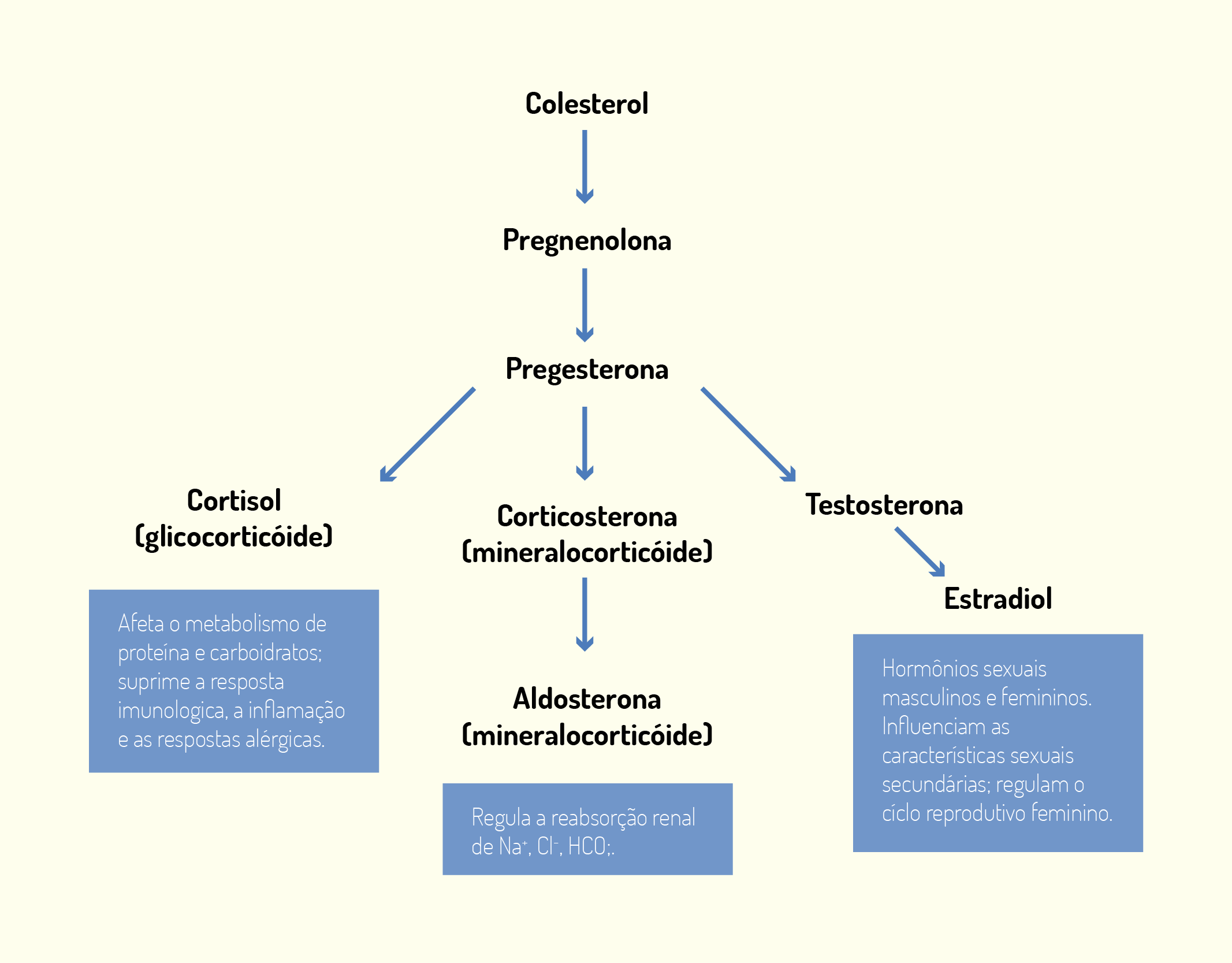
Como dissemos no início desta unidade, a membrana celular é formada por lipídios, proteínas e aminoácidos e é sobre cada um deles que falaremos a seguir. A membrana celular é constituída por uma dupla camada de lipídios. Os lipídios de membrana são moléculas anfipáticas, possuem uma extremidade polar ou hidrofílica (solúvel em água) e outra extremidade apolar ou hidrofóbica (insolúvel em água e solúvel em lipídios). As extremidades apolares estão voltadas para a região interna da membrana e as extremidades polares estão voltadas para o lado externo da membrana. Os principais lipídios encontrados nas membranas celulares são os fosfolipídeos de várias classes como os fosfoglicerídeos e esfingolipídeos, além do colesterol. O colesterol é dificilmente encontrado na membrana das células procarióticas. Já, a membrana das células vegetais não possui colesterol, no entanto, contém outros tipos de esteróis (NELSON; COX, 2006; JUNQUEIRA; CARNEIRO, 2012; DE ROBERTIS; HIB, 2016).
O colesterol é uma molécula muito hidrofóbica para formar sua própria bicamada e então, intercalar-se com moléculas de fosfolipídeos. O colesterol desempenha papel estrutural na membrana celular, impedindo um grande nível de compactação entre as cadeias de fosfolipídeos, mantendo, assim, um nível de fluidez na membrana e, ao mesmo tempo, a rigidez necessária. Quanto maior a quantidade de colesterol presente em uma membrana celular, menos fluida ela se torna. A membrana celular é dita fluida, porque seus componentes giram em torno do seu próprio eixo e deslocam-se pela superfície da membrana. Além da quantidade de esteróis na membrana, a temperatura também altera a sua fluidez, quanto menor a temperatura, menor o grau de fluidez. O nível de fluidez de uma membrana é uma característica muito importante para o crescimento e reprodução das células. Além disso, os lipídios da membrana celular estão distribuídos assimetricamente entre as duas camadas lipídicas. Alguns lipídios são encontrados principalmente na monocamada interna, bem como outros são encontrados, principalmente, na monocamada externa (NELSON; COX, 2006; JUNQUEIRA; CARNEIRO, 2012; LODISH et al., 2014).
Vimos que a membrana celular é formada por uma bicamada de lipídeos e, nesta camada, estão inseridas as proteínas. De acordo com o tipo de membrana a proporção de lipídios e proteínas pode variar. Por exemplo, a membrana da bainha de mielina, que recobre os axônios dos neurônios, é constituída por cerca de 80% de lipídios e 20% de proteínas. O inverso é observado na membrana mitocondrial interna, que é formada por cerca de 80% de proteínas e 20% de lipídios. A membrana celular contém uma grande diversidade de proteínas, onde cada tipo de membrana possui suas proteínas características, e são as principais responsáveis pela atividade metabólica da membrana. De acordo com a sua localização em relação à membrana celular, as proteínas podem ser divididas em dois grandes grupos: as proteínas integrais e as proteínas periféricas (NELSON; COX, 2006; DE ROBERTIS; HIB, 2016).
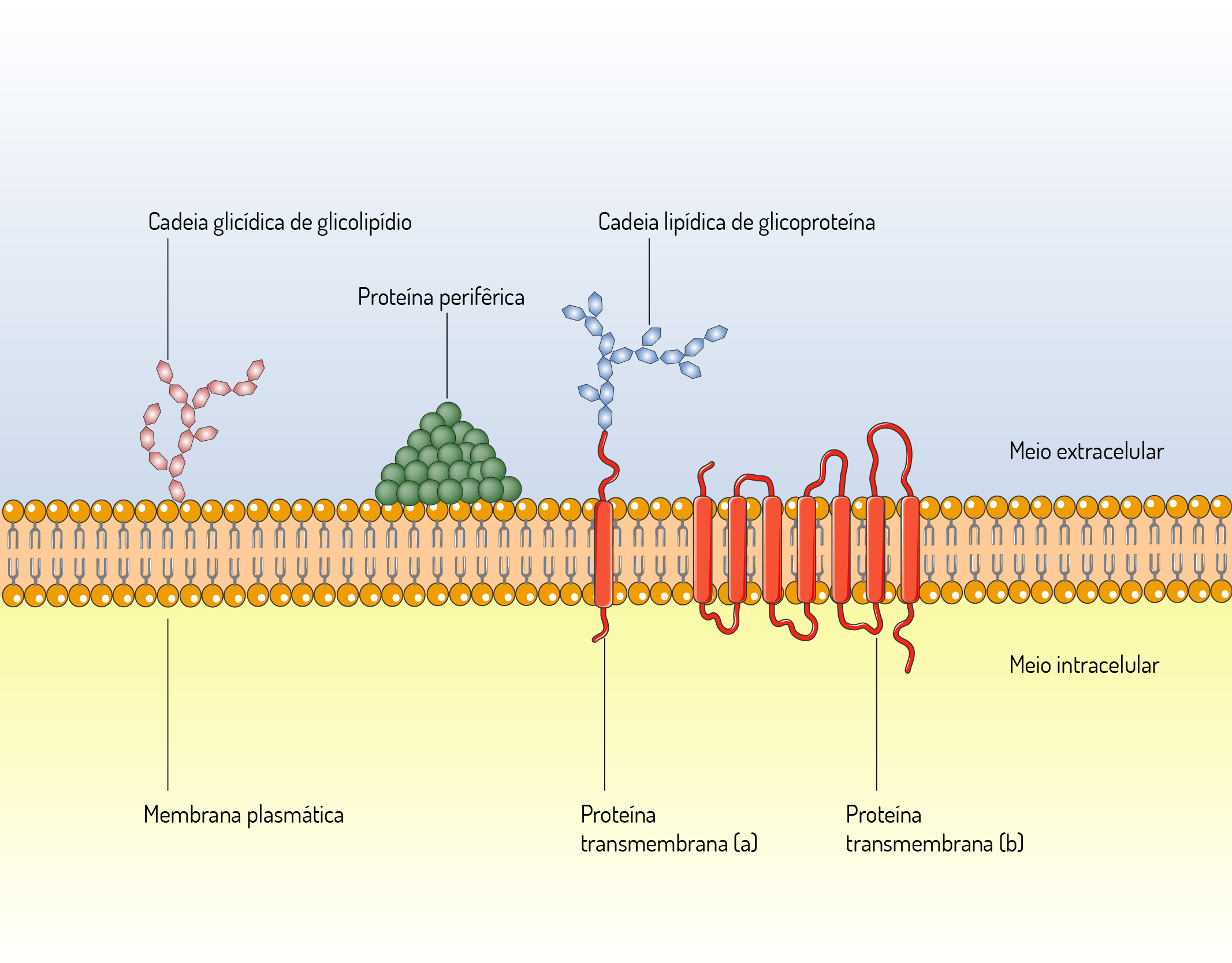
As proteínas integrais localizam-se encaixadas entre os lipídeos na membrana. Essas proteínas estão fortemente associadas aos lipídios e sua extração exige técnicas agressivas, como o uso de detergentes e solventes especiais, que interferem nas ligações hidrofóbicas. Assim como os lipídios, as proteínas também giram em torno de seus próprios eixos e se movimentam na bicamada lipídica. Algumas dessas proteínas localizam-se apenas em uma das faces da membrana celular, ou seja, não atravessam a bicamada fosfolipídica. No entanto, outras atravessam a bicamada lipídica e projetam-se nas superfícies interna e externa da membrana celular, sendo chamadas proteínas transmembranas (Figura 2.2). Algumas proteínas transmembranas apresentam-se muito longas e atravessam a bicamada lipídica mais de uma vez. Essas proteínas são chamadas proteínas transmembranas de passagem múltipla ou simplesmente multipasso (JUNQUEIRA; CARNEIRO, 2012; DE ROBERTIS; HIB, 2016).
2229 Membrana celular com representação das proteínas periféricas e integrais, glicolipídeos e glicoproteínas. (A) proteínas transmembrana de passagem única. (B) proteínas transmembrana de passagem múltipla Fonte: Junqueira; Carneiro (2012, p. 85).
As proteínas periféricas, também representadas na Figura 2.2, são proteínas que podem ser encontradas na face interna ou externa da membrana celular e não fazem contato com a região hidrofóbica da bicamada lipídica. Estas proteínas ligam-se à membrana celular indiretamente, através de interações com proteínas integrais ou proteínas ancoradas em lipídios e, diretamente, através de ligações com grupos apicais dos lipídios. Desta forma, podem ser extraídas com técnicas mais brandas, com o uso de soluções salinas que interferem nas ligações eletrostáticas e pontes de hidrogênio (NELSON; COX, 2006; LODISH et al., 2014).
Os carboidratos estão ligados a lipídios e proteínas da membrana celular, ou seja, são glicolipídios e glicoproteínas, que também podem ser observados na Figura 2.2. Os glicolipídeos podem ser classificados em cerebrosídeos (galactose ou glicose + ceramida) e gangliosídeos, onde o carboidrato é substituído por um oligossacarídeo que contém três ácidos siálicos. As glicoproteínas de membrana contêm oligossacarídeos ou polissacarídeos. Os polissacarídeos que se ligam à proteína são chamados glicosaminoglicanos e destes são formadas glicoproteínas chamadas proteoglicanos. Os carboidratos ligados aos lipídios e proteínas, localizados na superfície externa da membrana celular formam um revestimento chamado glicocálice. O glicocálice desempenha diversas funções como proteção da superfície da célula contra danos mecânicos, alguns oligossacarídeos do glicocálice participam de processos de reconhecimento e adesão celular, determinam a especificidade do sistema ABO de grupos sanguíneos, dentre outras (DE ROBERTIS; HIB, 2016).
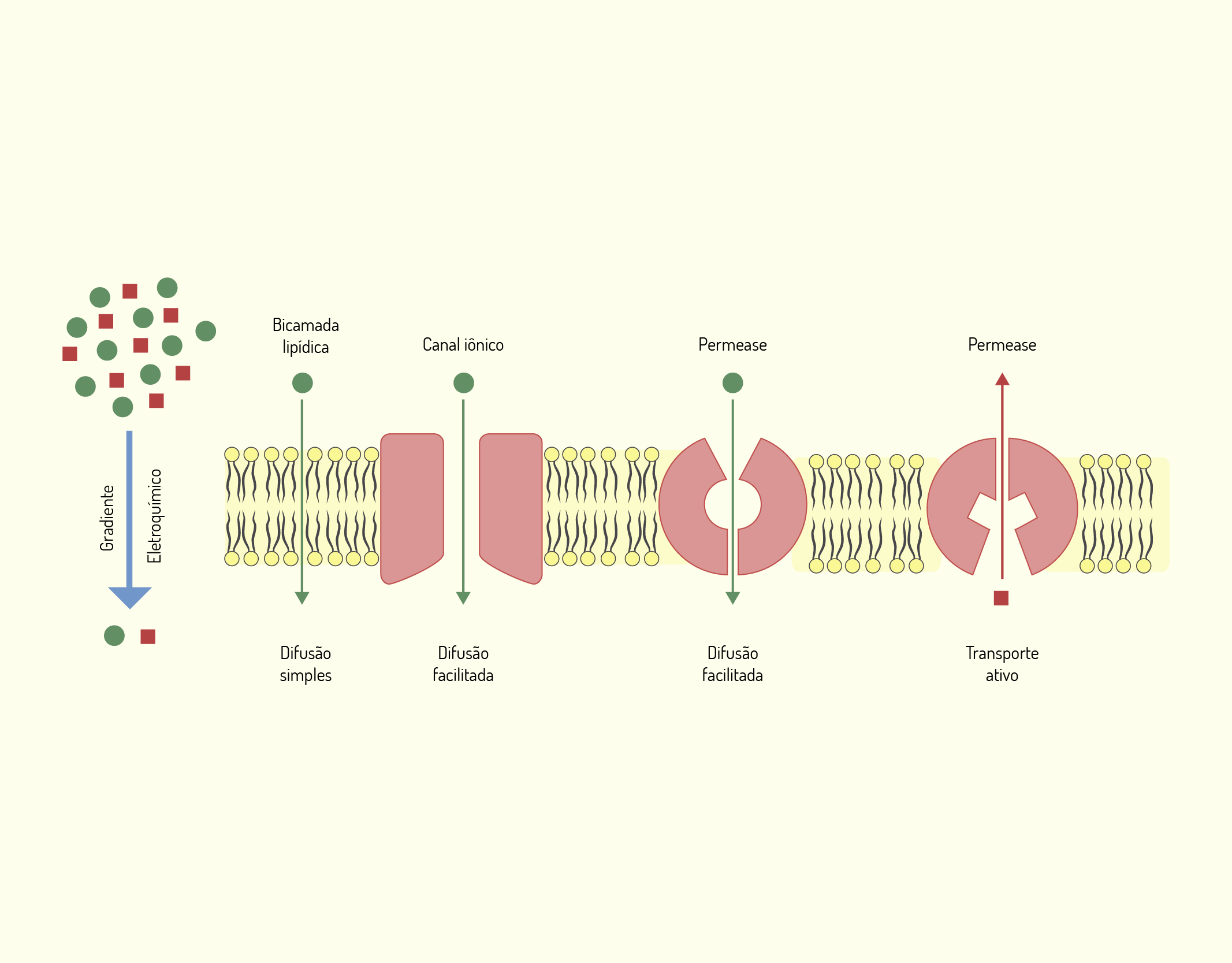
Agora que falamos sobre os principais constituintes da membrana celular, os lípidios, proteínas e carboidratos, falaremos sobre o transporte de solutos através da membrana. Veremos os mecanismos pelos quais os componentes extracelulares atravessam a membrana celular em direção ao meio intracelular e vice-versa. Esses mecanismos estão representados na Figura 2.3.
2329 Mecanismos e estruturas utilizados pelos solutos para atravessar a membrana celular Fonte: De Robertis; Hib et al. (2016, p. 44).
Nosso corpo é formado por cerca de 60% de água, onde os solutos (íons e moléculas pequenas) e as macromoléculas encontram-se dissolvidos. Normalmente, o lado interno da membrana é mais negativo em relação ao lado externo, o que favorece a difusão de íons positivos para o interior da célula. Além disso, íons como os íons de sódio (Na+) e cálcio (Ca2+) encontram-se, em maior concentração, no meio extracelular e, os íons de potássio (K+) encontram-se, em maior concentração, no meio intracelular. O movimento dos solutos entre compartimentos aquosos separados por um divisor permeável é chamado de difusão. Quando o movimento dos solutos ocorre do compartimento mais concentrado (com maior quantidade de determinada molécula ou íon) para o compartimento menos concentrado é um processo chamado difusão simples. Esse mecanismo tem por objetivo alcançar um equilíbrio entre os meios intracelular e extracelular, ou seja, a distribuição uniforme dos solutos. Quando os solutos difundem-se do meio mais concentrado para o meio menos concentrado é dito que ele está indo à favor do seu gradiente de concentração, que é a diferença entre as concentrações de solutos entre compartimentos separados por um divisor permeável (membrana). Se os solutos tiverem carga elétrica, a diferença elétrica é chamada gradiente de voltagem, ou, ainda, potencial elétrico. A combinação dos gradientes de concentração e elétrico é chamada gradiente eletroquímico. A difusão simples ocorre a favor do gradiente, é um processo espontâneo e não há gasto de energia (NELSON; COX, 2006; DE ROBERTIS; HIB et al., 2016).
Apenas substâncias lipossolúveis como ácidos graxos e esteróis e, molécula apolares pequenas como O2, CO2 e N2, atravessam a membrana celular por difusão simples. A maioria dos solutos é impedida de atravessar a membrana celular por esse mecanismo. Compostos polares e íons precisam de uma via alternativa para atravessar a bicamada lipídica. Outro mecanismo de transporte é a difusão facilitada. Na difusão facilitada, a força que impulsa o movimento dos solutos também é o gradiente e, também, não há gasto de energia. O que diferencia a difusão simples da difusão facilitada, é que a difusão facilitada ocorre através de canais iônicos ou de permeases (NELSON; COX, 2006; DE ROBERTIS; HIB et al., 2016).
Os canais iônicos são poros hidrofílicos que atravessam a membrana celular e são formados por proteínas transmembranas de passagem múltipla. Esses canais são muito seletivos, de forma que, para cada tipo de íon existe um canal específico. Os canais iônicos são de dois tipos: canais dependentes de voltagem, que se abrem em resposta à alteração do potencial elétrico e os canais dependentes de ligantes, canais que se abrem quando uma substância indutora (ligante) liga-se ao canal iônico e promove a sua abertura. As permeases, assim como os canais iônicos, são formadas por proteínas de passagem múltipla e possuem locais de ligação específicos que são chamados sítios de ligação. Estes sítios de ligação são acessíveis por um lado ou pelos dois lados da membrana celular. Quando o soluto fixa-se na permease, modifica a conformação da mesma, o que possibilita a passagem de material para o outro lado da membrana (NELSON; COX, 2006; DE ROBERTIS; HIB et al., 2016).
A difusão simples e a difusão facilitada são tipos de transporte passivo, pois são mecanismos que não consomem energia e são à favor de uma gradiente. Um outro mecanismo de transporte de solutos, através da membrana, é chamado transporte ativo. Neste caso, para que o processo aconteça, há gasto de energia. O transporte ativo é o mecanismo em que o transporte de soluto ocorre contra o gradiente e, para que isso ocorra, é necessário gasto de energia. Este tipo de transporte ocorre através de permeases chamadas de bombas e o exemplo mais difundido deste tipo de transporte é o sistema bomba sódio/potássio (Na+/K+). A bomba de sódio/potássio estabelece as diferenças nas concentrações de sódio (Na+) e potássio (K+) entre o meio intracelular (citosol) e extracelular, sendo responsável pelo potencial elétrico. A bomba de sódio/potássio envia íons de sódio para fora da célula e íons de potássio para dentro da célula, numa proporção de três íons de sódio para cada dois íons de potássio. Desta forma, a bomba sódio/potássio é responsável pela manutenção do potencial elétrico (DE ROBERTIS; HIB et al., 2016).
Especializações de membrana
No decorrer deste tópico falamos sobre composição, características e tipos de transportes da membrana celular. Esta, ainda, possui algumas especializações de acordo com a localização da célula dentro do organismo, de forma que essas especializações visam suprir alguma função que a célula execute em determinado local. Entre as especializações de membrana incluem: microvilosidades, estereocílios, desmossomos, junção aderente, zônulas oclusivas, complexo juncional e junções comunicantes (JUNQUEIRA; CARNEIRO, 2012).
A microvilosidade é uma especialização de membrana característica de células que têm a função de absorver diversas substâncias. As microvilosidades são prolongamentos que aumentam a área superficial da célula. As células que revestem a superfície interna do intestino delgado são células que apresentam em sua superfície numerosas microvilosidades, onde têm como função aumentar a superfície de absorção da célula de forma a facilitar o transporte de nutriente da cavidade intestinal para o interior da célula (JUNQUEIRA; CARNEIRO, 2012).
Estereocílios são prolongamentos imóveis que também têm como função aumentar a área de contato da célula, assim como as microvilosidades. No entanto, os estereocílios diferem das microvilosidades por apresentarem comprimento maior, ramificam-se, frequentemente, e são encontrados apenas em algumas células epiteliais como as células que revestem ductos do aparelho genital masculino. Já, as microvilosidades são encontradas em muitos tipos de células (JUNQUEIRA; CARNEIRO, 2012).
Os desmossomos têm como função unir uma célula à outra, possuem a forma de uma placa arredondada e são formados pela membrana de duas células adjacentes. Na face citoplasmática de cada membrana é notada uma camada amorfa chamada placa do desmossomo, onde se inserem filamentos que se aprofundam para o interior da célula. Desta forma, os desmossomos tratam-se de locais onde o citoesqueleto se prende à membrana celular, formando um elo de ligação do citoesqueleto de células adjacentes. É uma especialização presente em células que sofrem com tração, como células da epiderme e do músculo cardíaco (JUNQUEIRA; CARNEIRO, 2012).
A junção aderente éencontrada em determinados epitélios de revestimento circundando a região apical das células, ou seja, se dispõem como um cinturão ao redor da célula, promovendo a união destas com células vizinhas. Nos dois lados da membrana citoplasmática há a formação de uma placa onde se inserem microfilamentos de actina que fazem parte do citoesqueleto (JUNQUEIRA; CARNEIRO, 2012).
A zônula oclusiva é uma especialização que tem como função bloquear, parcialmente ou totalmente, o trânsito de íons e moléculas por entre as células. A zônula oclusiva trata-se de uma faixa contínua em torno da porção apical de determinadas células epiteliais, permitindo a formação de compartimentos separados (JUNQUEIRA; CARNEIRO, 2012).
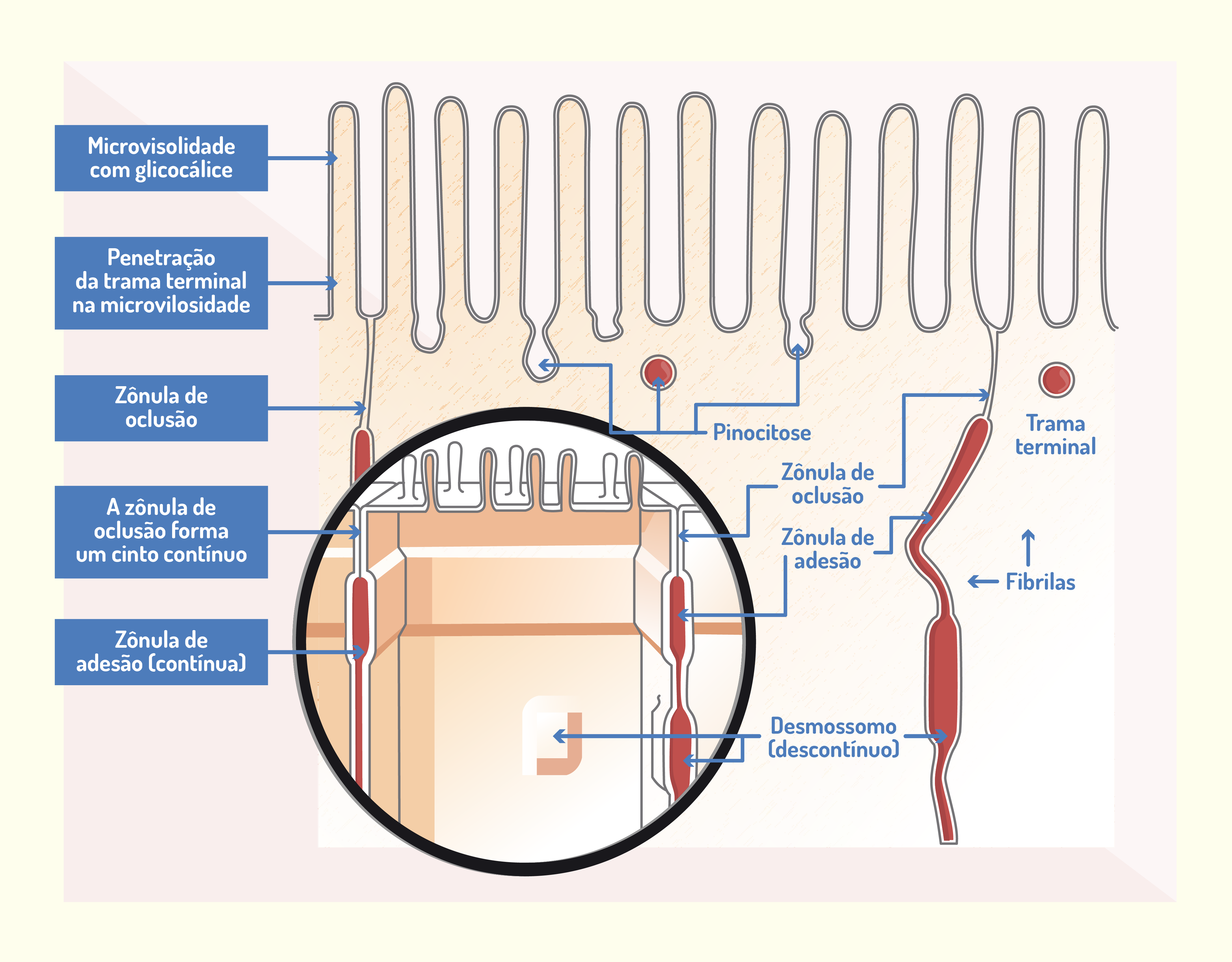
O complexo juncional trata-se de um conjunto de junções formado pela junção aderente, zônula oclusiva e os desmossomos. É encontrado próximo à extremidade livre da célula, como no epitélio do tubo digestório, e pode ser observado na Figura 2.4 (JUNQUEIRA; CARNEIRO, 2012).
2429 Esquema do complexo juncional presente em células do intestino delgado Fonte: Junqueira; Carneiro (2012, p. 100).
Nas junções comunicantes, as células estão separadas por uma distância muito pequena, cerca de 2 nm (nanômetros) e são constituídas por tubos formados por proteínas que atravessam a membrana das duas células. Desta forma, as junções comunicantes permitem a passagem de aminoácidos e íons entre as células, fazendo com que grupos celulares funcionem de maneira ordenada. No entanto, as junções comunicantes não permitem a passagem de macromoléculas como proteínas e ácidos nucleicos (JUNQUEIRA; CARNEIRO, 2012).
Núcleo
Finalizamos o tópico sobre membrana celular falando sobre sua composição, estrutura e características. À seguir, falaremos sobre as estruturas internas da célula. Neste tópico discutiremos sobre o núcleo e, mais adiante, falaremos sobre as organelas e as diversas funções que essas estruturas desempenham nas células.
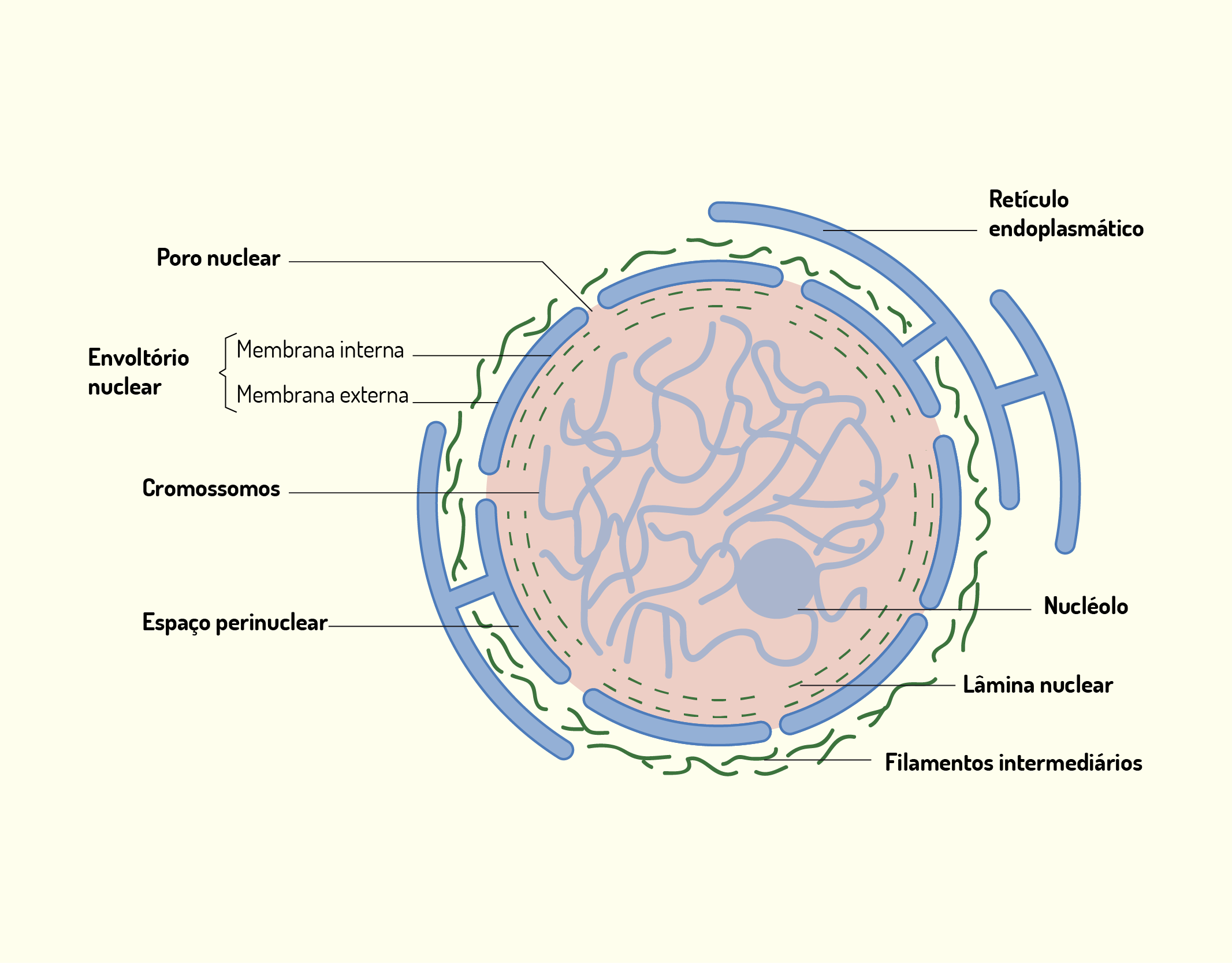
O núcleo é a principal característica que diferencia uma célula eucarionte de uma célula procarionte. Ele é o local onde grande parte da informação genética da célula está contida, a porção restante localiza-se nas mitocôndrias. A maioria das células possuem um núcleo e, frequentemente, este se localiza no centro da célula, ele, também, é a estrutura delimitada pelo envoltório nuclear, composto por duas membranas concêntricas (Figura 2.5) (DE ROBERTIS, HIB, 2016).
2529 Representação do núcleo celular Fonte: De Robertis; Hib et al. (2016, p. 181).
A membrana interna do envoltório nuclear funde-se com a membrana externa formando orifícios, chamados de poros e o espaço entre essas duas membranas é chamado cisterna perinuclear. É, através dos poros, que ocorre a comunicação entre o interior do núcleo e o citosol da célula. O lado interno do envoltório nuclear associa-se à uma rede de filamentos formando a lâmina nuclear. Já, o lado externo, na superfície citoplasmática, são encontrados vários ribossomos aderidos, além disso, este lado do envoltório nuclear apresenta continuidade com o retículo endoplasmático rugoso, organela que estudaremos mais adiante (JUNQUEIRA; CARNEIRO, 2012; DE ROBERTIS; HIB, 2016).
Os poros são associados com complexos de poros, que são agregados de proteínas que estão envolvidos com a regulação do trânsito de moléculas entre o citoplasma e o núcleo. Esse complexo é composto por proteínas, coletivamente chamadas de nucleoporinas. As moléculas podem atravessar o complexo proteico por transporte ativo ou passivo. Água e moléculas pequenas atravessam o complexo de poro nos dois sentidos, no entanto, proteínas e RNA são moléculas transportadas por mecanismos que consomem energia. Essas moléculas passam por mecanismos de reconhecimento e, então, são transportadas seletivamente (JUNQUEIRA; CARNEIRO, 2012; DE ROBERTIS; HIB, 2016).
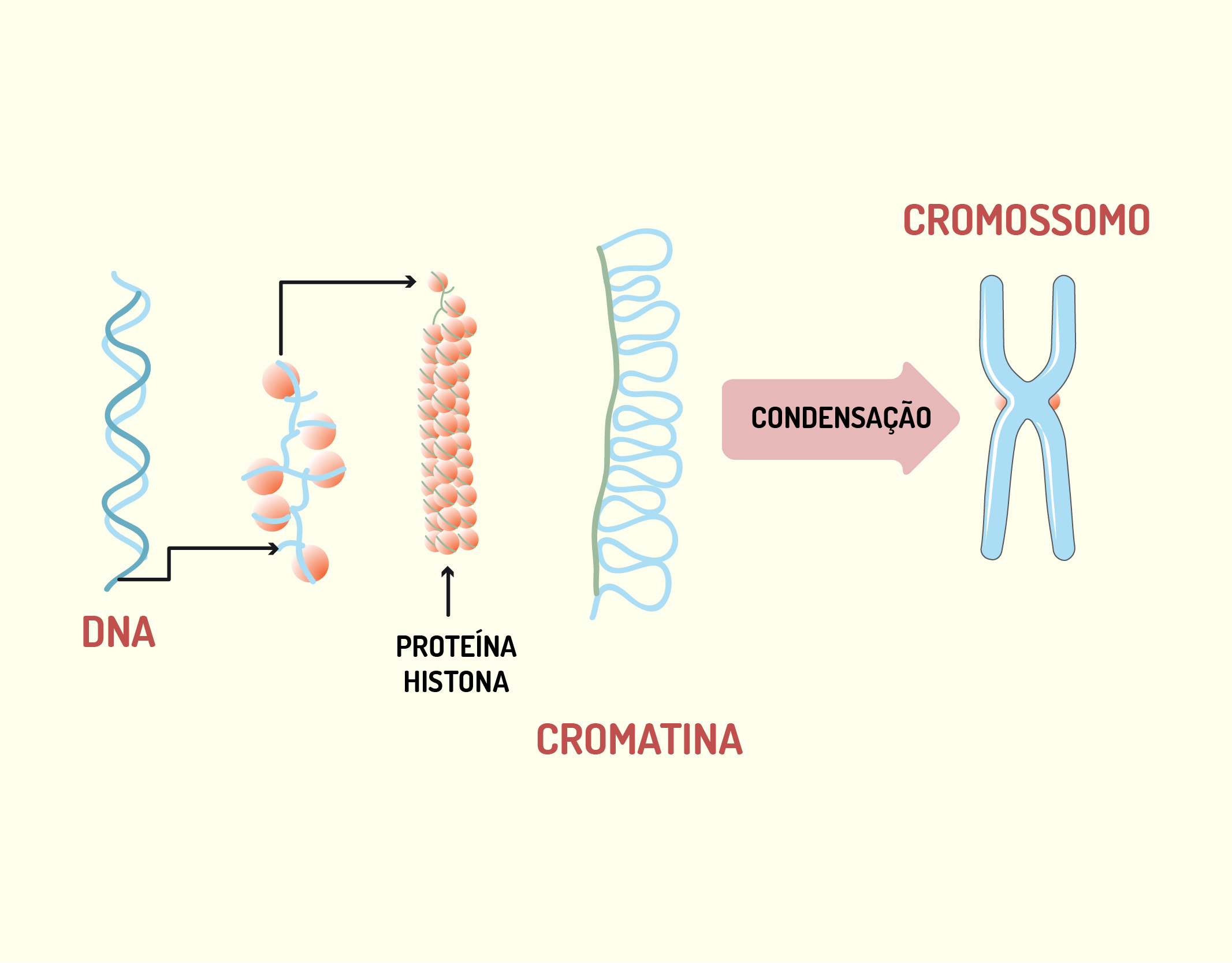
Como dissemos no começo deste tópico, grande parte do material genético das células é encontrado no núcleo. O material genético encontrado dentro do núcleo está na forma de cromatina, que é um complexo formado por DNA (ácido desoxirribonucleico), histonas e proteínas não histônicas. Durante as fases do ciclo celular, a cromatina altera sua conformação, quando o núcleo está em interfase a cromatina encontra-se descompactada, como se estivesse desenrolada. Já, quando o núcleo está em mitose ou meiose, ou seja, em divisão, a cromatina está altamente compactada formando, então, os cromossomos. Desta forma, a cromatina e os cromossomos são estados morfológicos e fisiológicos da mesma estrutura (JUNQUEIRA; CARNEIRO, 2012; DE ROBERTIS; HIB, 2016).
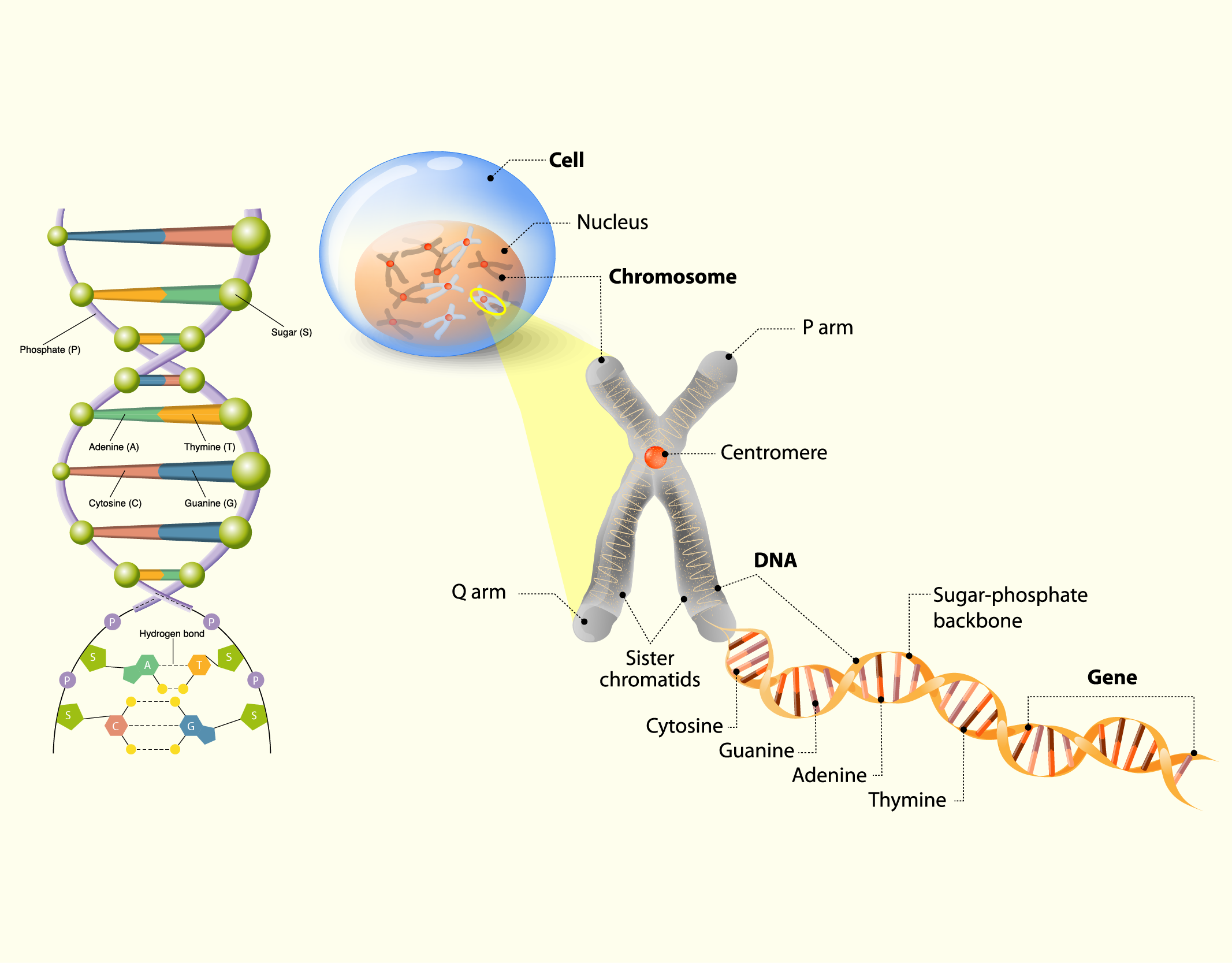
O DNA é a molécula onde está contida a informação genética que governa todas as atividades do organismo, como o controle básico do metabolismo celular, síntese de macromoléculas e transmissão da herança genética de uma célula para as células descendentes. O DNA é formado por duas cadeias de nucleotídeos complementares, dispostas em forma de hélice, em torno de um eixo. Por sua vez, os nucleotídeos são formados por uma molécula de ácido fosfórico, uma pentose e uma base nitrogenada, sendo estas representadas por letras: A (adenina), T (timina), C (citosina) e G (guanina), onde A é complementar a T e C é complementar a G. A estrutura do DNA pode ser observada na Figura 2.6 (JUNQUEIRA; CARNEIRO, 2012; DE ROBERTIS; HIB, 2016).
2629 (A) Estrutura em hélice do DNA; (B) compactação do DNA resultando na formação dos cromossomos Fonte: (A) ROBERTO BIASINI, 123RF; (B) DESIGNUA, 123RF.
O DNA apresenta-se associado à proteínas chamadas proteínas histonas, que desempenham papel fundamental no enovelamento da cromatina. As proteínas histonas são formadas por lisina e arginina, aminoácidos carregados positivamente que conferem a essas proteínas a capacidade de unirem-se às moléculas de DNA, nas quais predominam cargas negativas. De acordo com o teor de lisina, as proteínas histonas são classificadas em: H1, H2A, H2B, H3 e H4 e essas proteínas associam-se ao DNA, formando vários níveis de compactação (Figura 2.7) (JUNQUEIRA; CARNEIRO, 2012; DE ROBERTIS; HIB, 2016).
Já, as proteínas não histônicas incluem todas as proteínas do núcleo, com exceção das proteínas histonas, sendo que estas proteínas podem estar dispersas no núcleo ou ligadas ao DNA. As proteínas não histônicas participam de diversas funções, como nos processos de replicação e reparo do DNA, das estruturas dos cromossomos e na ativação e repressão gênica (JUNQUEIRA; CARNEIRO, 2012).
Outra estrutura presente no núcleo é o nucléolo. Os nucléolos são estruturas esféricas não envolvidas por membrana, onde ocorre a transcrição e processamento do rRNA (RNA ribossômico) e, também, a montagem do ribossomo (organela que estudaremos mais adiante). Células em que ocorre uma intensa síntese de proteínas, que secretam proteínas ou, ainda, se reproduzem com frequência, possuem nucléolos maiores que os outros tipos de células. Desta forma, o tamanho dos nucléolos, geralmente, está relacionado com atividade de síntese de proteínas na célula (JUNQUEIRA; CARNEIRO, 2012; COOPER; HAUSMAN, 2014).
Mas o que é transcrição e rRNA que acabamos de mencionar no parágrafo anterior? Nós vimos que o DNA é uma molécula constituída por dupla cadeia de nucleotídeos e é nesta molécula que está contida a informação genética. Essa informação é copiada, ou melhor dizendo, transcrita para a molécula de mRNA (RNA mensageiro), que, por sua vez, contém sequências de nucleotídeos que formam um código que determina aminoácido para a formação das proteínas. Esse é o dogma central da biologia molecular, onde o fluxo de informação genética segue do DNA [math]to [/math] RNA [math]to [/math] Proteínas. O fluxo de informação do DNA para o RNA ocorre pelo processo chamado transcrição. O RNA é transcrito à partir de uma molécula de DNA e o RNA é traduzido em um proteína, processo esse chamado de tradução. Ainda, respondendo nossa pergunta no começo deste parágrafo, existem três tipos principais de RNA: mRNA (RNA mensageiro), rRNA (RNA ribossômico) e o tRNA (RNA transportador). O mRNA carrega a informação genética do DNA, que estabelece a sequência de aminoácidos na proteína. O rRNA corresponde a 50% da massa de um ribossomo e, por fim, o tRNA é responsável por identificar e transportar os aminoácidos até os ribossomos e esses três tipos de RNAs atuam na síntese das proteínas. São três características que diferem a molécula de DNA de RNA: (1) o RNA é constituído por uma cadeia de nucleotídeos (o DNA é formado por duas cadeias); (2) a pentose do RNA é a ribose, no DNA a pentose é a desoxirribose; (3) por fim, as bases nitrogenadas timina e uracila - o RNA não possui timina, há a existência de uma uracila em vez de timina, da mesma forma que, o DNA não possui uracila, há a existência de uma timina em vez da uracila (DE ROBERTIS, HIB, 2016).
Organelas
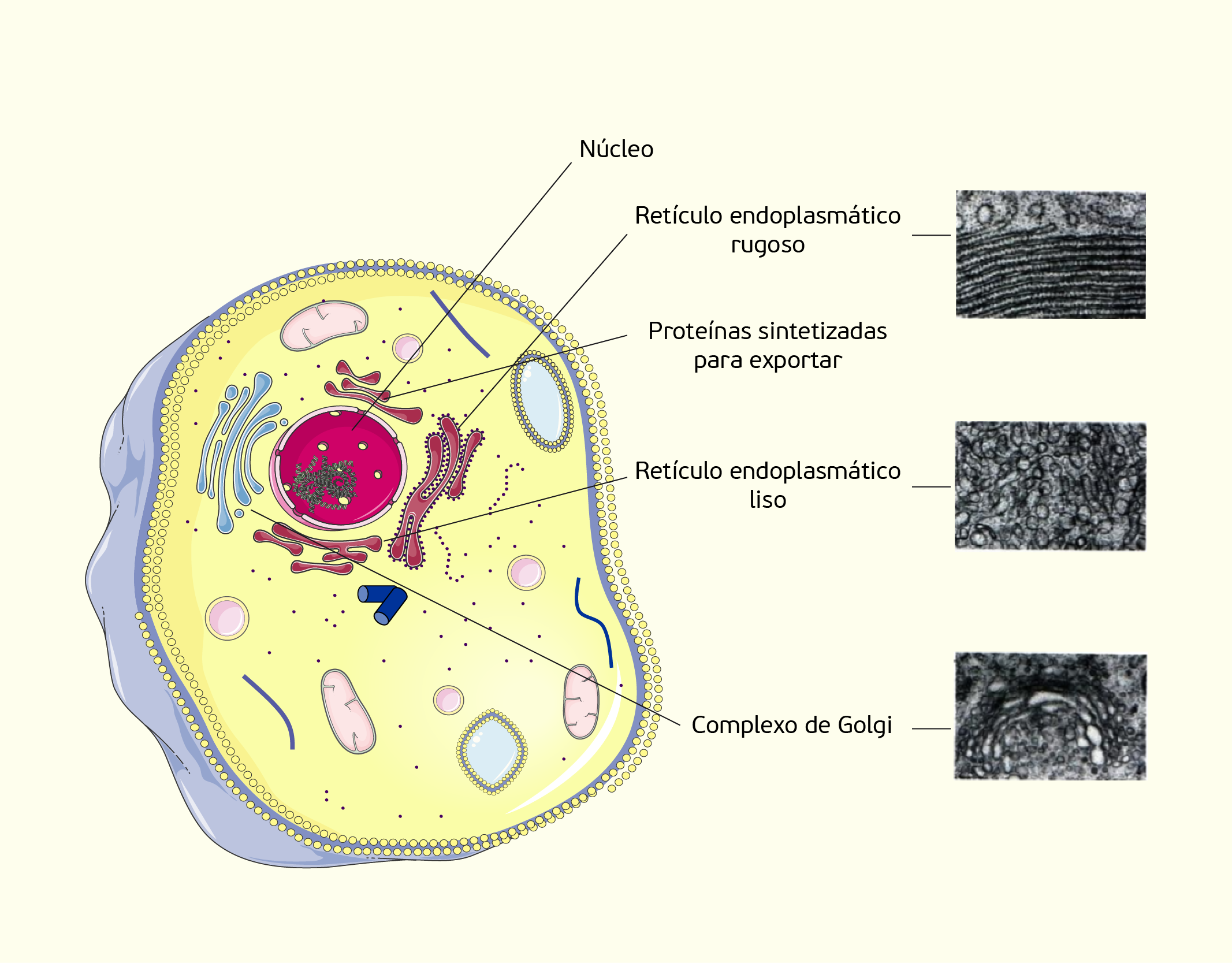
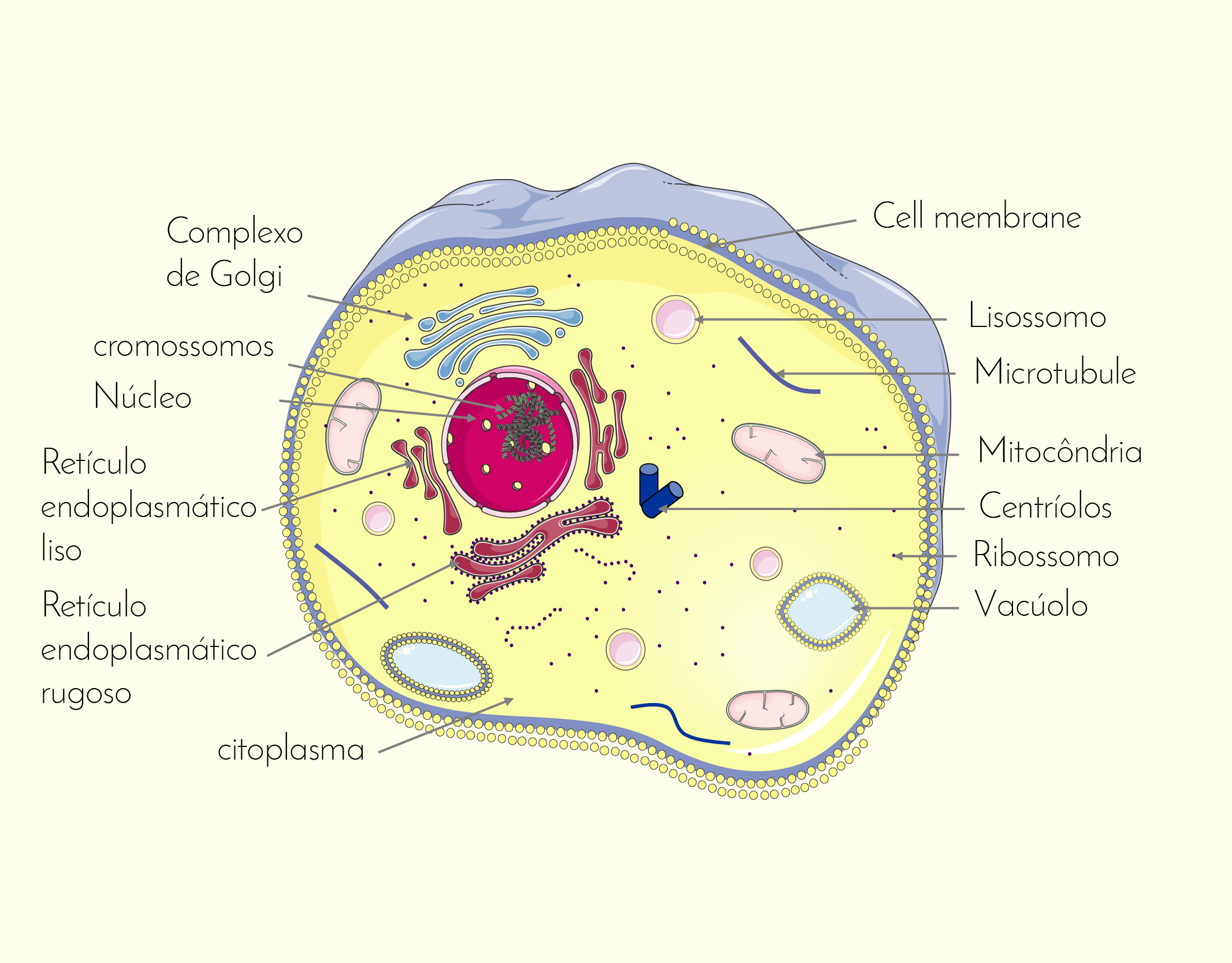
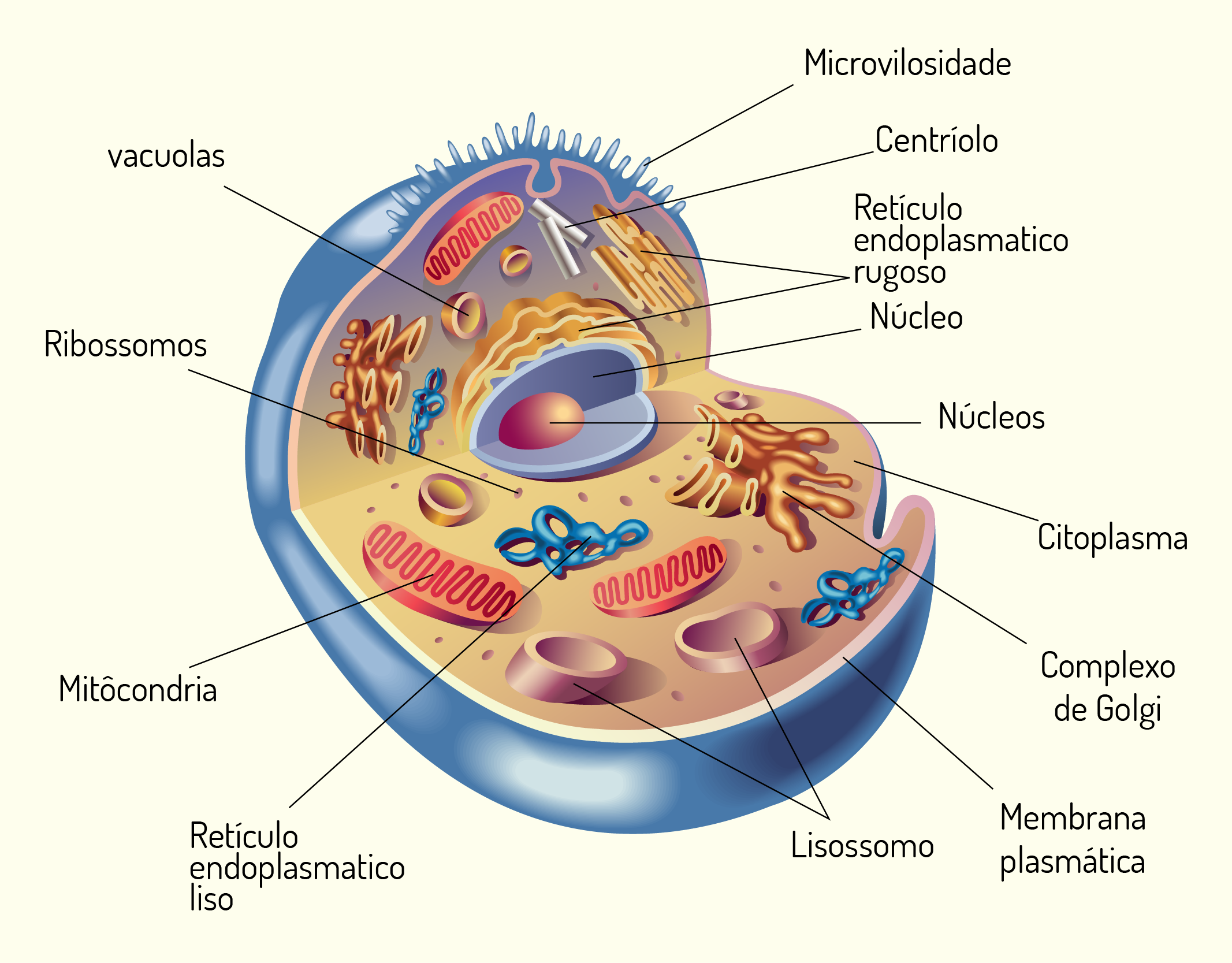
Além do núcleo, no citoplasma das células também são encontradas as organelas (Figura 2.8), que são estruturas organizadas que executam funções específicas no interior da célula. Muitas organelas são envolvidas por uma membrana semelhante à membrana celular. Cada tipo de organela possui um conjunto específico de proteínas para executar determinada função celular. Embora haja algumas variações, as organelas são semelhantes em todas as células, onde cada organela é responsável por uma atividade especializada necessária para a sobrevivência da célula. A seguir falaremos sobre essas estruturas que constituem as células (SHERWOOD, 2011).
2829 Imagem de uma célula onde estão representados seus principais componentes Fonte: ROBERTO BIASINI, 123RF.
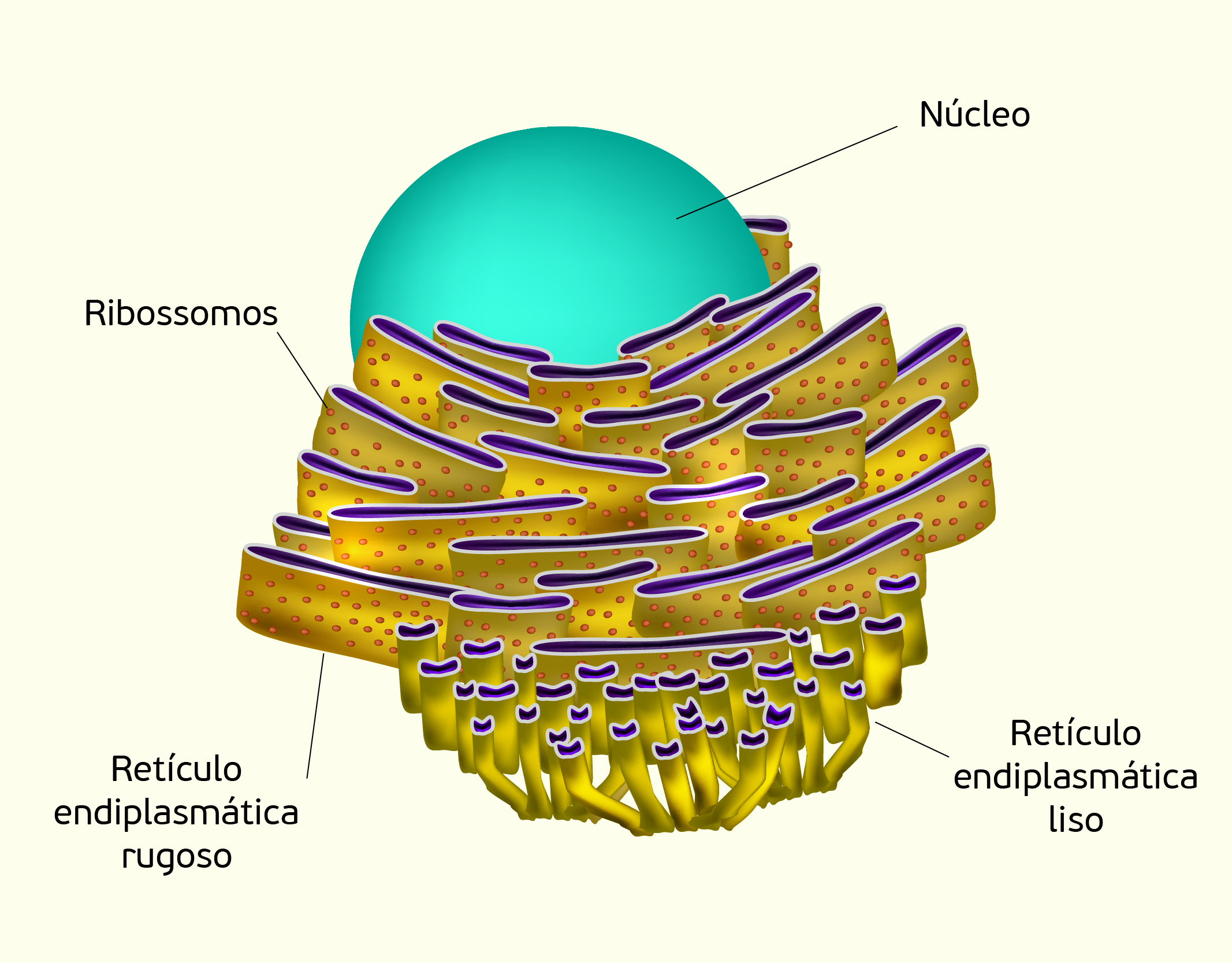
O retículo endoplasmático (RE) (Figura 2.9) é uma rede membranosa repleta de fluido, que se estende desde a membrana do núcleo e por todo o citoplasma. Esta organela está relacionada com a produção, processamento e transporte de proteínas e pode ser diferenciada em dois tipos: o RE rugoso e RE liso. O RE rugoso tem sua superfície externa coberta por ribossomos (falaremos sobre os ribossomos mais adiante), que dão a essas organelas uma aparência rugosa quando observada ao microscópio óptico. Os ribossomos associados ao RE rugoso sintetizam e liberam diversas proteínas no lúmem do RE. Essas proteínas são produzidas com dois objetivos: (1) algumas delas são responsáveis por transportar diversas substâncias para o exterior da célula; (2) outras proteínas são produzidas e transportadas para diversas regiões dentro da célula e são utilizadas para a construção de novas membranas celulares, ou então, outros componentes proteicos. Já, o RE liso não possui ribossomos sobre sua superfície e não estão envolvidos com o processo de síntese de proteínas. O RE liso é responsável, principalmente, por embalar e despachar moléculas a serem transportadas pelo RE. Proteínas recém-sintetizadas e lipídios movem-se até alcançar o RE liso onde agrupam-se. Partes do RE liso formam vesículas de transporte que envolvem essas moléculas, como se embalasse essas moléculas em uma cápsula derivada da membrana do RE liso (SHERWOOD, 2011).
2929 Representação de retículo endoplasmático Fonte: GUNIITA, 123RF.
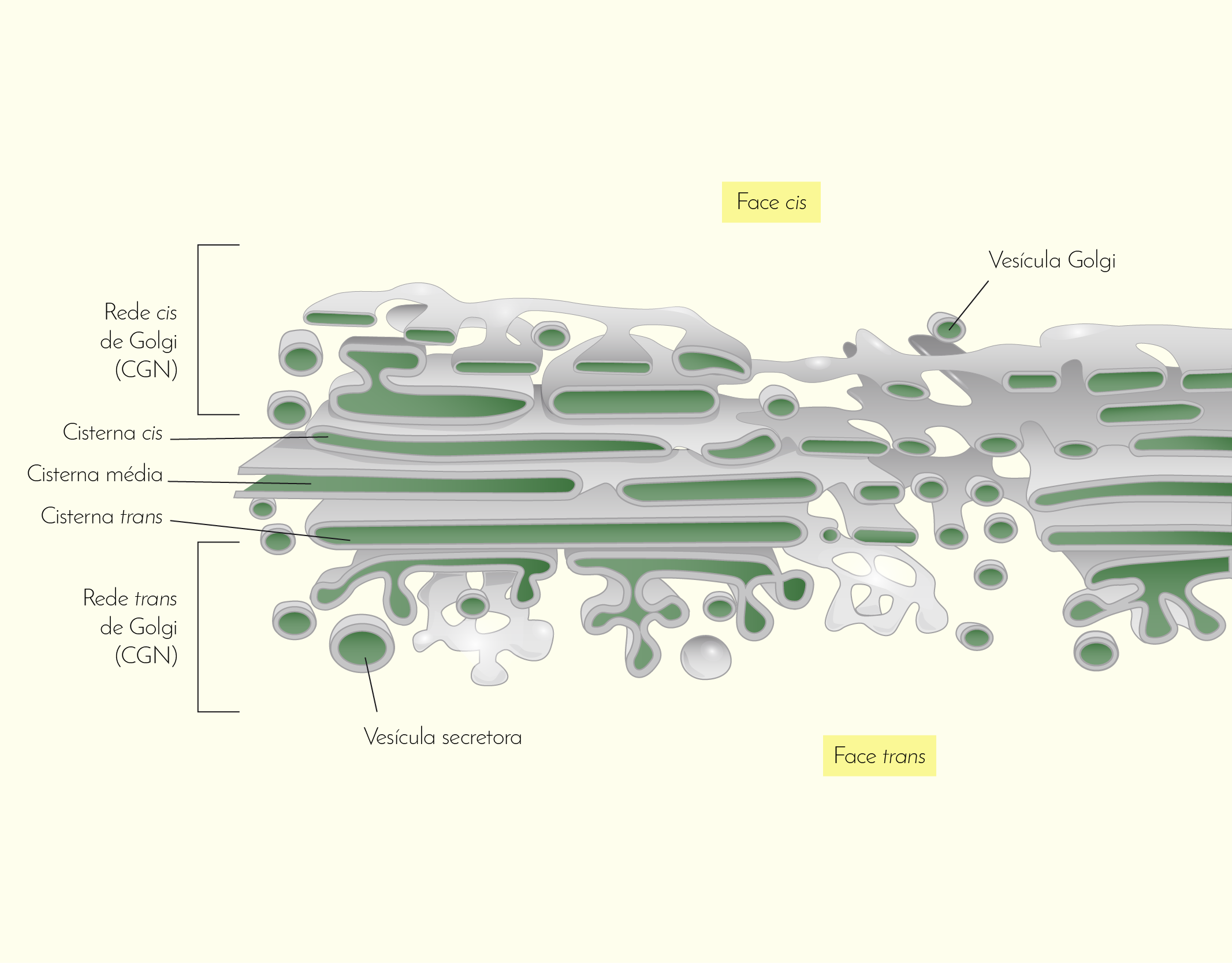
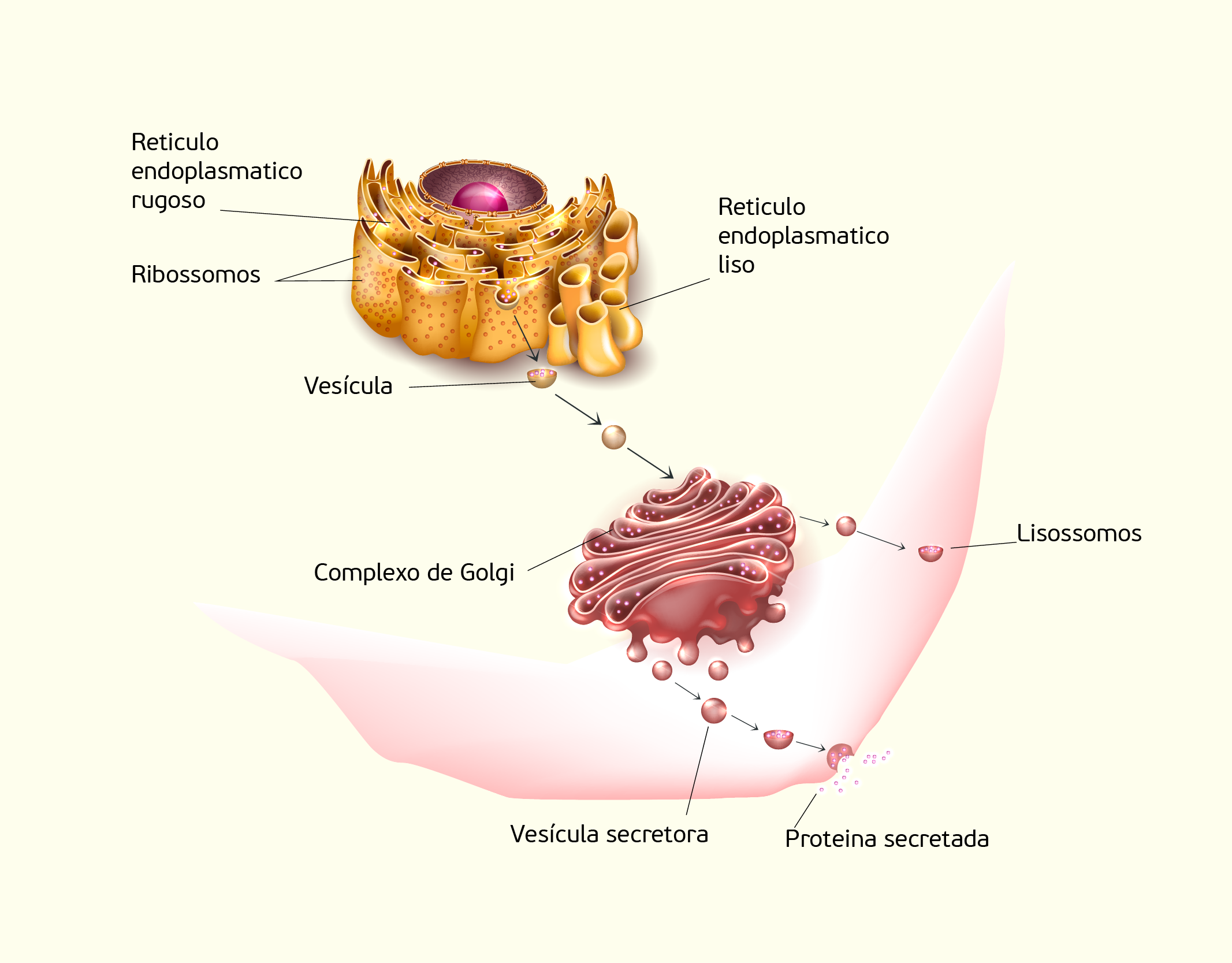
O Complexo de Golgi ou aparelho de Golgi (Figura 2.10)consiste em um pilha de sacos levemente curvos e achatados envolvidos por uma membrana e estão intimamente relacionados com o RE. No complexo de Golgi, as proteínas recebidas do RE passam um processamento adicional e são separadas para que sejam transportadas para seus destinos. As moléculas recém-sintetizadas pelo RE (lembre-se que essas moléculas estão em vesículas) dirigem-se ao complexo de Golgi. Quando atinge o complexo de Golgi, a membrana da vesícula abre-se e integra-se à membrana do complexo de Golgi liberando seu conteúdo no interior deste último. Esse conteúdo vai percorrendo os sacos do complexo de Golgi onde ocorrem muitas funções importantes: processamento das proteínas em produto final (no interior do complexo de Golgi as proteínas “brutas” passam por um processamento para formar um produto final) e classificação e direcionamento (as proteínas são classificadas e separadas de acordo com sua função destino) (SHERWOOD, 2011).
21029 Imagem de uma célula em uma visão geral do processo de secreção das proteínas produzidas pelo retículo endoplasmático e se direcionam para o complexo de Golgi. Fonte: Sherwood (2011, p. 26).
As margens do complexo de Golgi são mais salientes e é, nesta região, que o produto final é coletado. O saco mais externo do complexo de Golgi forma uma nova vesícula envolvendo o produto final e para cada produto final uma vesícula com proteínas superficiais específicas é formada. Essas proteínas superficiais servem como um marcador (como um endereço em um envelope), desta forma, a vesícula pode ancorar ou liberar seu conteúdo quando encontra o receptor do marcador. Assim, essas vesículas chegam aos locais adequados porque são classificadas e endereçadas e são entregues para receptores específicos (SHERWOOD, 2011).
Os Lisossomos são pequenas organelas envolvidas por membranas onde estão contidas enzimas que são capazes de hidrolisar diversos tipos de moléculas orgânicas como proteínas, lipídios, carboidratos e ácidos nucleicos. Desta forma, os lisossomos funcionam como um sistema digestivo da célula, que degrada o material captado a partir do exterior da célula, além de degradar componentes obsoletos da própria célula, como organelas desgastadas. Os lisossomos não apresentam uma estrutura uniforme como as demais organelas e possuem forma e tamanho variados dependendo do tipo de molécula que estão digerindo. No entanto, geralmente, apresentam formatos esféricos ou ovais (COOPER; HAUSMAN, 2007; SHERWOOD, 2011).
Peroxissomos são organelas membranosas que contêm enzimas oxidativas. Estas enzimas utilizam o oxigênio (O2) para retirar hidrogênio de outras moléculas, com o objetivo de desintoxicar resíduos produzidos pelas células ou compostos estranhos. Estas organelas recebem esse nome por produzir e degradar o peróxido de hidrogênio (H2O2), uma molécula potencialmente destrutiva se acumulada. O peróxido de hidrogênio é formado por oxigênio e átomos de hidrogênio retirados de moléculas tóxicas. No entanto, os peroxissomos também decompõe o peróxido de hidrogênio em H2O e O2 através da enzima catalase, enzima presente em grande quantidade nos peroxissomos (SHERWOOD, 2011; DE ROBERTIS; HIB, 2016).
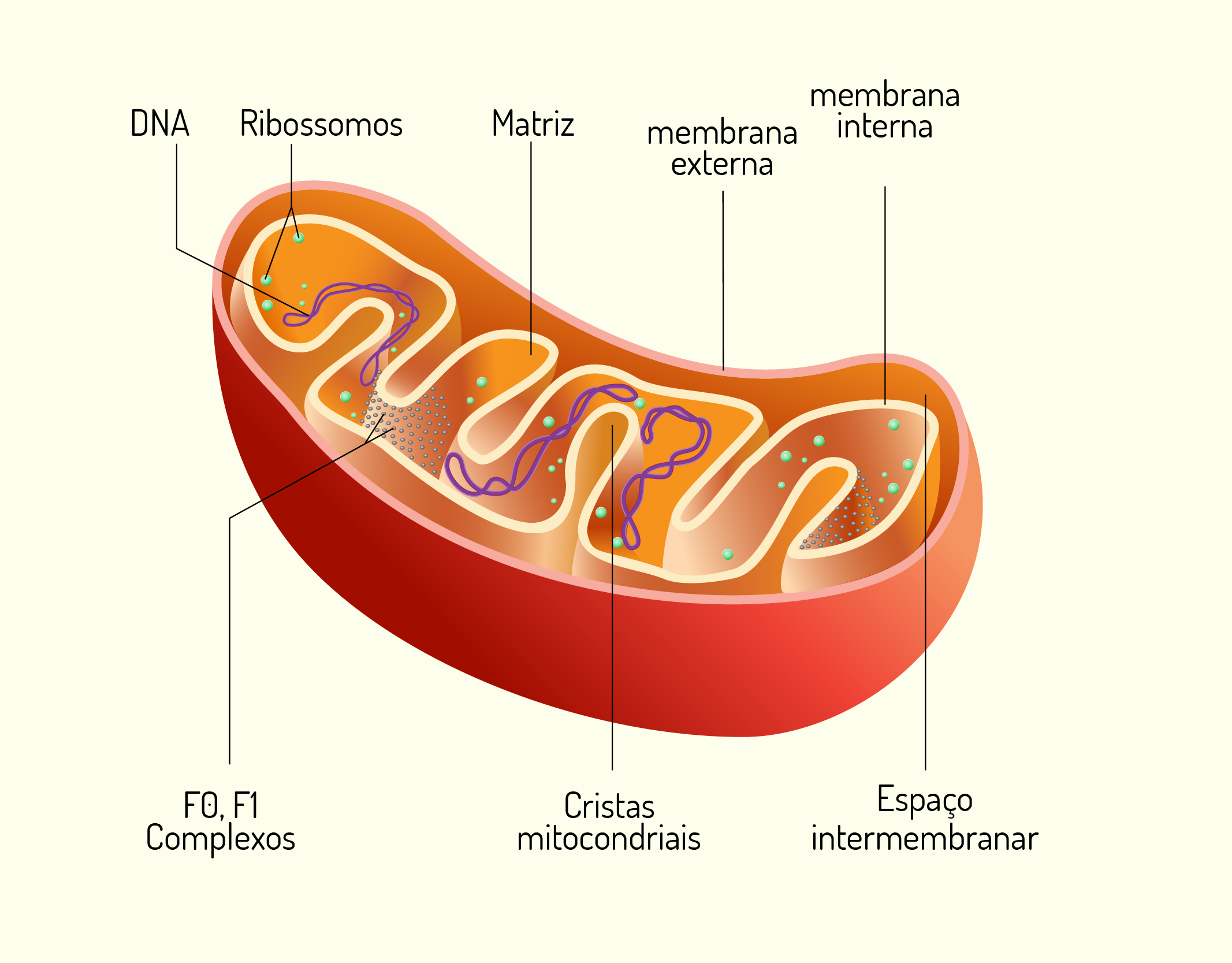
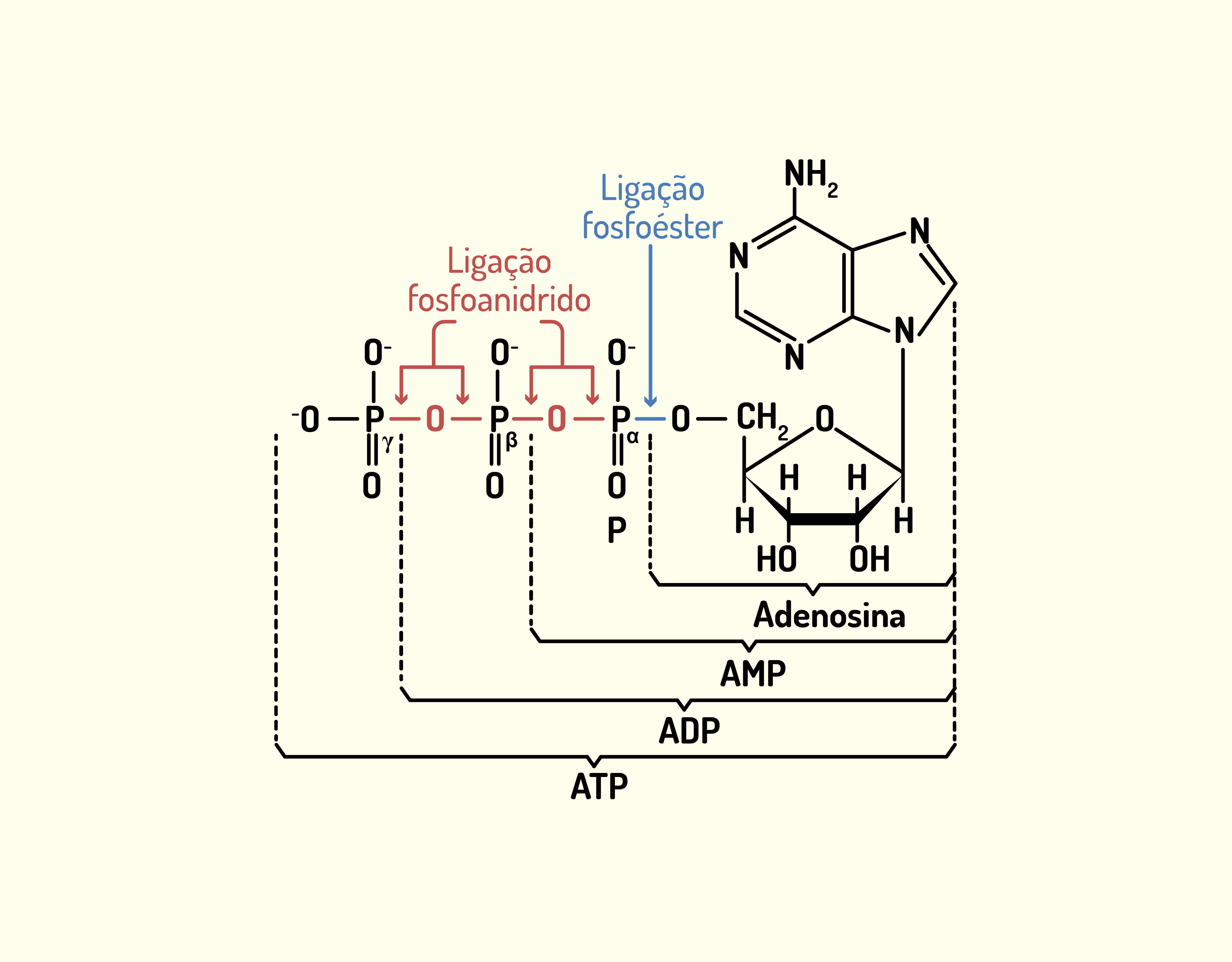
As Mitocôndrias (Figura 2.11) são consideradas as “usinas energéticas” das células. Grande parte da energia que as células necessitam para sobreviver e realizar suas atividades é gerada pelas mitocôndrias. Essas organelas retiram energia dos nutrientes dos alimentos e transformam em energia utilizável pelas células, ou seja, em ATP (adenosina trifosfato) que consiste em adenosina e três grupos fosfato acoplados e é o combustível químico que energiza a maioria das atividades celulares. As mitocôndrias são estruturas ovaladas com formato cilíndrico e são envolvidas por uma membrana dupla, uma externa lisa que delimita a mitocôndria e outra interna que forma uma série de dobras chamadas cristas. Essas cristas são formadas com o objetivo de aumentar a superfície membranosa e contêm proteínas que são produzidas para converter a energia dos alimentos em ATP. As células do nosso corpo não são capazes de utilizar energia diretamente dos alimentos, desta forma, elas convertem a energia dos nutrientes em uma forma utilizável, o ATP. Assim, quando uma ligação de alta energia se quebra, como a que liga o fosfato terminal à adenosina, uma grande quantidade de energia é liberada, fornecendo energia para o uso da célula (SHERWOOD, 2011; DE ROBERTIS; HIB, 2016).
21129 Representação de um mitocôndria Fonte: SNAPGALLERIA, 123RF.
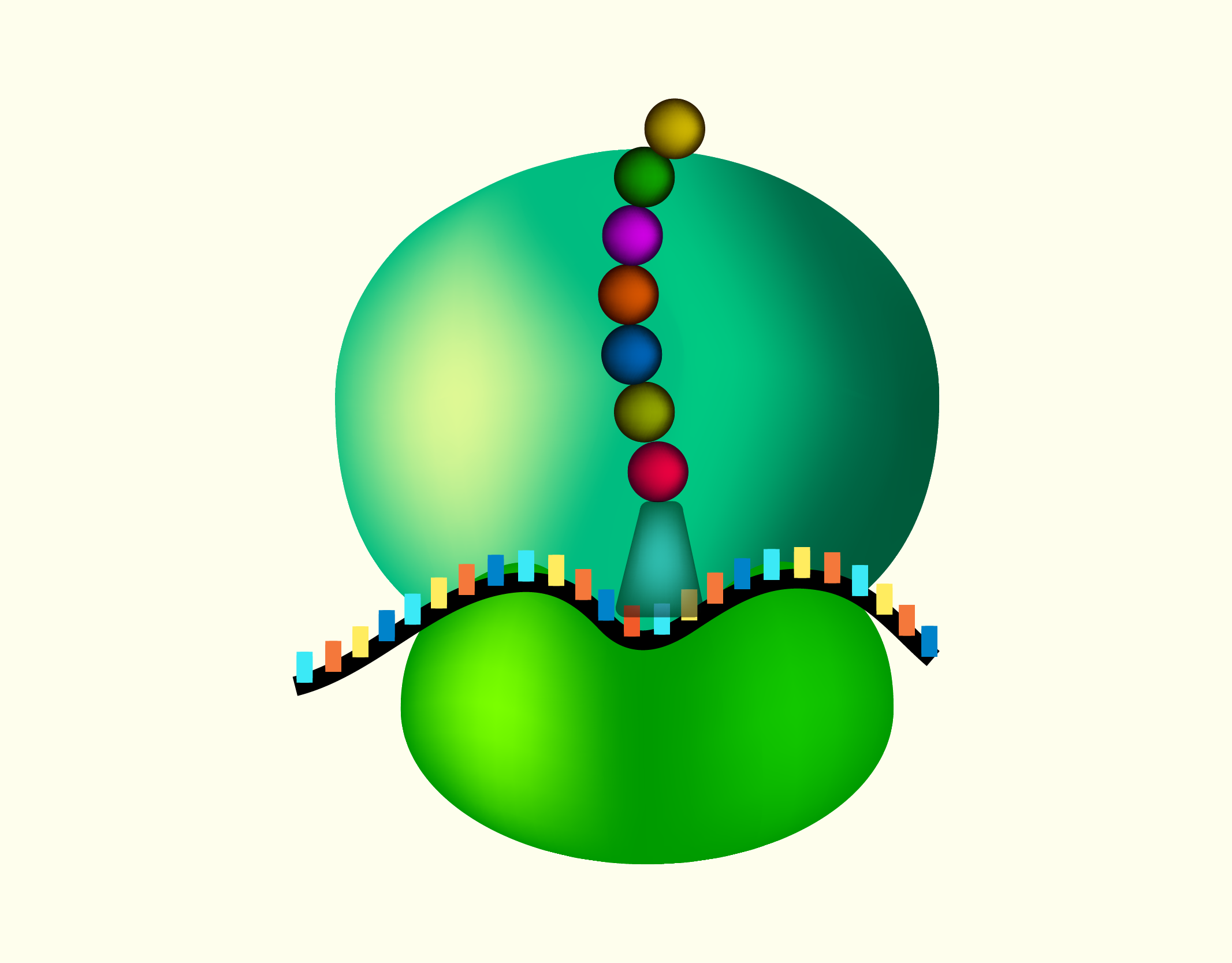
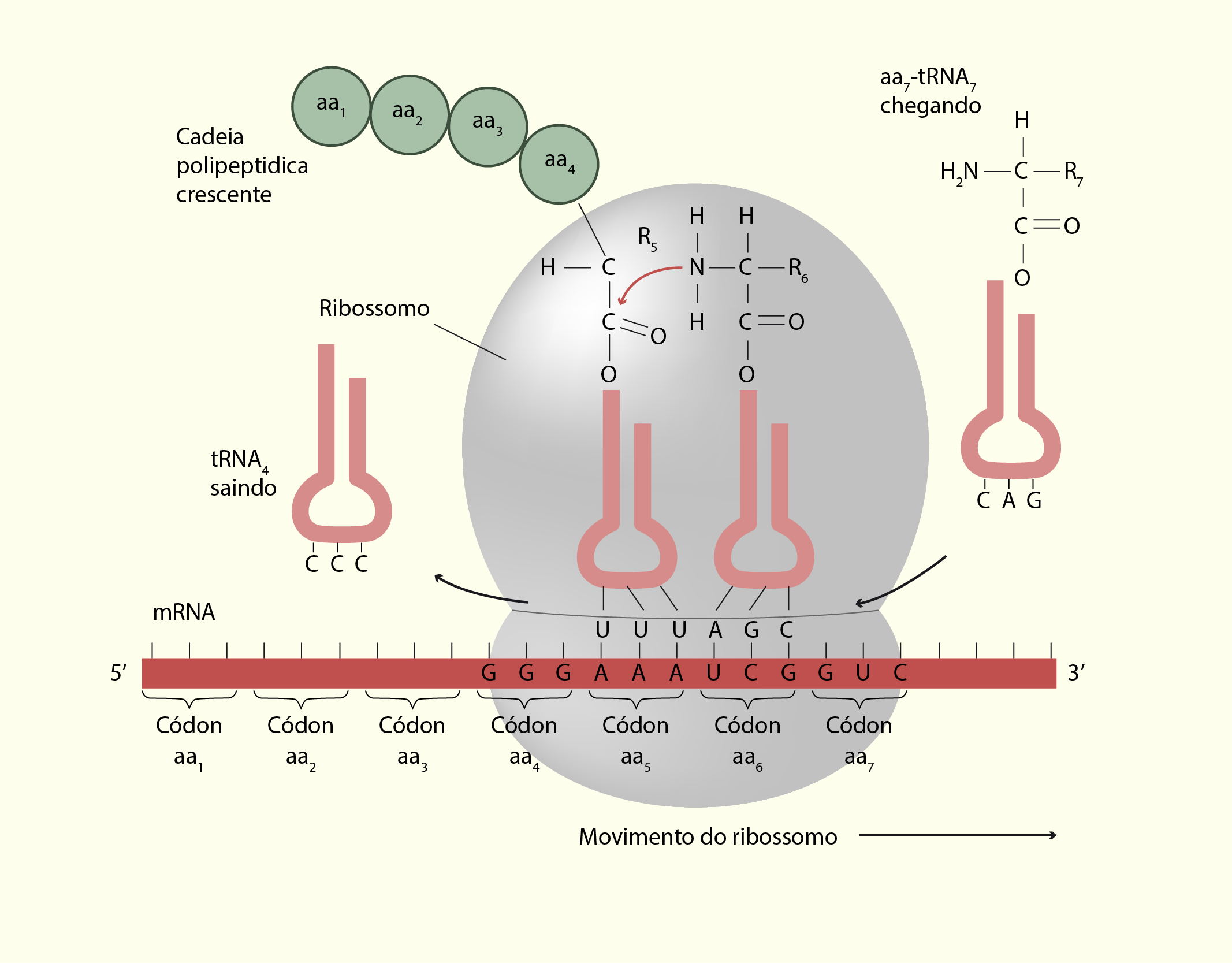
Os Ribossomos (Figura 12) são as organelas responsáveis pela síntese de proteínas ao traduzir o mRNA (RNA mensageiro) em cadeias de aminoácidos que formam as proteínas. Os ribossomos unem os elementos envolvidos na síntese das proteínas que incluem o mRNA, tRNA (RNA transportador) e os aminoácidos e fornecem as enzimas necessárias para promover a união dos aminoácidos e, assim, formar as proteínas. Essas organelas existem livres no citosol ou acoplados ao RE rugoso e são compostas por duas subunidades, uma maior e outra menor. Essas subunidades são compostas por rRNA (RNA ribossômico) e proteínas ribossômicas. Quando ocorre a síntese de uma proteínas, as duas unidades se unem e, nesta união, um sulco é formado entre as duas unidades por onde o mRNA move-se durante o processo de tradução (SHERWOOD, 2011).
21229 Representação de um ribossomo durante a síntese proteica Fonte: A SAÚDE EM PAUTA, 123RF.
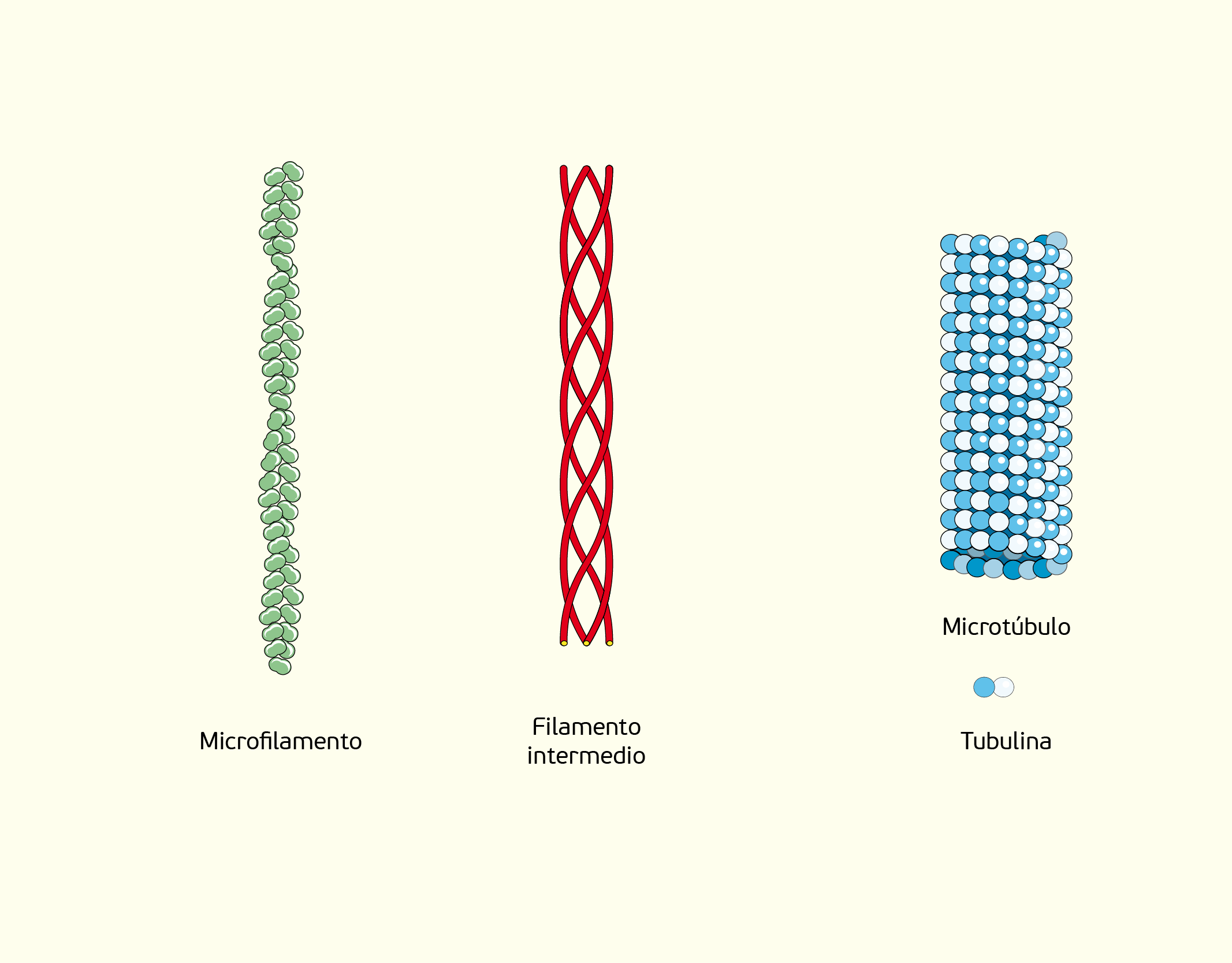
Citoesqueleto: os diferentes tipos de células possuem formato, estrutura e especializações funcionais diferentes. O citoesqueleto é a estrutura responsável pela manutenção dessas características particulares de cada célula. Ele é comparado com ossos e músculos do corpo e atua apoiando e organizando as estruturas dos componentes celulares, além do controle do movimento destes componentes. Três elementos compõem o citoesqueleto: (1) microtúbulos, (2) microfilamentos e (3) filamentos intermediários (Figura 2.12) (SHERWOOD, 2011).
Os microtúbulos são tubos longos e ocos compostos por tubulina que, por sua vez, é uma pequena molécula proteica globular. Estes tubos atuam posicionando organelas, sendo também essenciais na manutenção do formato de células assimétricas como, por exemplo, os axônios dos neurônios e, em conjunto com os filamentos intermediários, os microtúbulos estabilizam os axônios dos neurônios. Além disso, os microtúbulos também desempenham outras funções na células como transporte de vesículas secretoras, movimento de cílios e flagelos e distribuição dos cromossomos durante a divisão celular. Na divisão no processo de mitose, os cromossomos são duplicados e precisam ser separados, sendo levados para os lados opostos da célula para que assim, o material genético seja igualmente distribuído entre as células-filhas. Quando os cromossomos são duplicados eles precisam ser direcionados para os pólos da célula, isso se dá através de um aparato chamado fuso mitótico. Esse aparato é formado à partir dos microtúbulos e também são, momentaneamente, formados durante a divisão celular (SHERWOOD, 2011).
Os microfilamentos mais comuns de grande parte das células são formados por actina, uma molécula proteica com formato globular. A actina forma dois cordões que se entrelaçam para formar um microfilamento, que atua em diversos sistemas contráteis celulares como contração muscular, divisão e locomoção celular. Os músculos contêm uma grande quantidade de actina e miosina (proteína que forma um outro tipo de microtúbulo nas células musculares), que realizam a contração muscular através do deslizamento de microfilamentos de actina em relação aos microfilamentos estacionários de miosina, sendo este deslizamento ativado por ATP (“moeda energética” da célula). Na divisão celular, durante a citocinese, (processo em que o citoplasma da célula é dividido entre as duas células-filhas), um feixe semelhante a um cinto, formado por filamentos de actina, localizados logo abaixo da membrana plasmática, contrai-se e comprime a célula, como se fosse um cinto apertando a célula, até que ela se divida em duas partes (SHERWOOD, 2011).
Os centríolos (Figura 2.14) consistem em um par de estruturas cilíndricas localizadas no centro do centrossomo, que é o centro de organização da célula. Os centríolos são estruturas que participam do processo de divisão celular (SHERWOOD, 2011)
21429 Representação dos centríolos Fonte: ALILA, 123RF.
Atividades
Com relação às estruturas celulares e também às suas funções é correto o que se afirma em:
- O processamento final, classificação direcionamento das proteínas ocorrem nos nucléolos.
Os nucléolos são estruturas esféricas não envolvidas por membrana, onde ocorre a transcrição e processamento do rRNA e também a montagem do ribossomo. O processamento, classificação e direcionamento das proteínas ocorrem no complexo de Golgi.
- A energia que as células necessitam para executar suas funções é gerada pelas mitocôndrias.
Grande parte da energia que as células necessitam para sobreviver e realizar suas atividades é gerada pelas mitocôndrias. Essas organelas retiram energia dos nutrientes dos alimentos e transformam em energia utilizável pelas células, ou seja, em ATP.
- A membrana celular é uma camada composta por lipídeos, ácidos nucleicos e proteínas e atua como uma barreira impermeável. .
a membrana celular é uma camada composta por lipídios, proteínas e carboidratos que delimita a célula separando o meio intracelular do meio extracelular, no entanto, a membrana celular possui uma permeabilidade seletiva que controla a entrada e saída de substâncias. Já, os ácidos nucleicos são macromoléculas formadas por nucleotídeos.
- A bomba sódio/potássio é um tipo de transporte passivo através da membrana celular.
A bomba de sódio/potássio é um tipo de transporte ativo, mecanismo em que o transporte do soluto ocorre contra o gradiente e consome energia. Uma vez que os íons de potássio são mais concentrados no interior da célula e os íons de sódio mais concentrados no exterior da célula, a bomba sódio/potássio envia íons de sódio para fora da célula e íons de potássio para dentro da célula. Desta forma, o transporte do soluto no sistema da bomba sódio/potássio é contra o gradiente e, portanto, com consumo de energia.
- Os ribossomos são organelas responsáveis pela degradação do peróxido de hidrogênio.
Os ribossomos são as organelas envolvidas com a síntese de proteínas. Já, as organelas responsáveis pela degradação do peróxido de hidrogênio são os peroxissomas através da enzima catalase presente em grande quantidade nestas organelas.
Síntese de proteínas
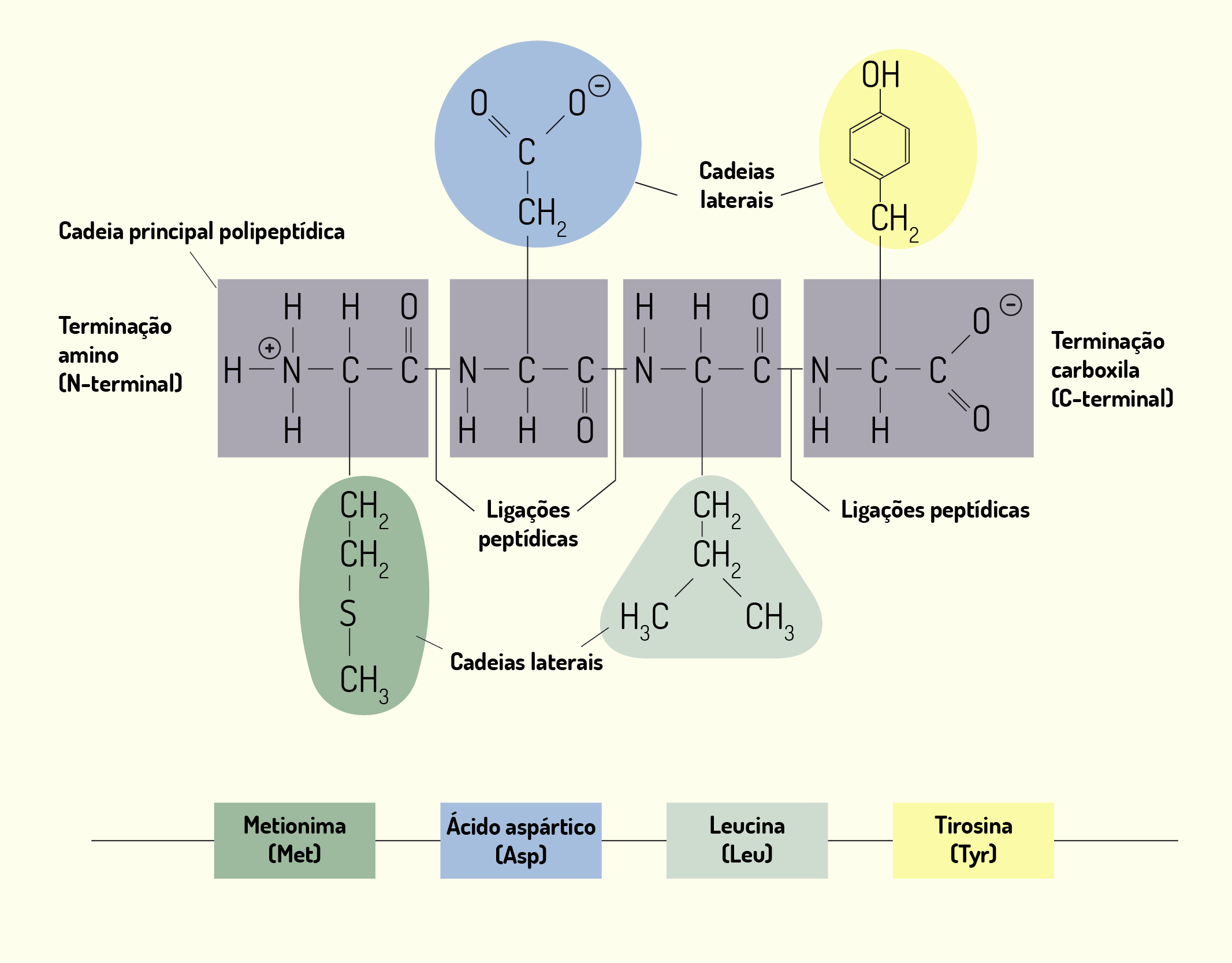
As proteínas são componentes químicos constituídos por aminoácidos combinados em diferentes proporções (existem 20 aminoácidos). A diversificação estrutural das proteínas reflete suas diferentes funções, sendo consideradas componentes macromoleculares multifuncionais. As proteínas também estão envolvidas com funções estruturais, como nos microfilamentos e microtúbulos, função informacional, como nos hormônios proteicos, dentre outras funções (JUNQUEIRA; CARNEIRO, 2012).
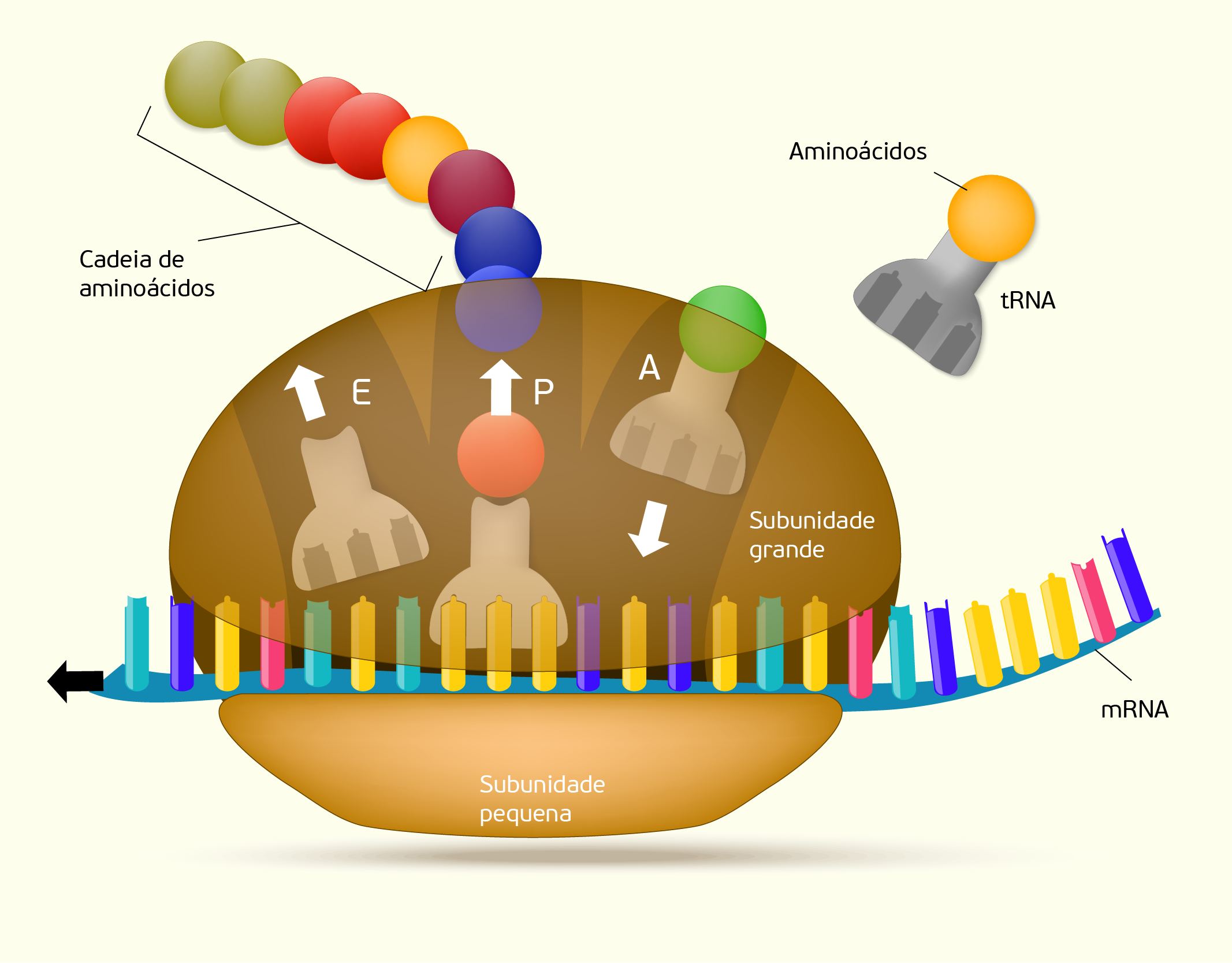
Nós vimos que a organela envolvida com a produção das proteínas é o ribossomo que, por sua vez, é formado por rRNA (RNA ribossômico) e proteínas, sendo constituído por duas subunidades, uma grande e outra pequena. No ribossomo existem três locais (Figura 2.15), chamados de sítio de ligação: sítio E (saída, exit), sítio P (peptidil) e sítio A (aminoacil). No sítio A ocorre a ligação entre um aminoacil-tRNA que possui um códon complementar ao códon do mRNA ligado a subunidade pequena do ribossomo. O sítio P é o local onde ocorre a ligação do tRNA iniciador e dos demais tRNA depois de passarem pelo sítio A. Por fim, o sítio E é onde tRNA sem o aminoácido é liberado do ribossomo (DE ROBERTIS; HIB, 2016).
21529 Esquema de um ribossomo durante a síntese proteica Fonte: Sherwood (2011, p. 40).
Nosso DNA contém a informação genética e o fluxo de informação do DNA para RNA é chamado transcrição. Se a molécula de RNA for um mRNA poderá construir uma proteína à partir dele em um processo chamado de tradução. No processo de tradução, a sequência de nucleotídeos de um mRNA é utilizada como molde para unir os aminoácidos na ordem correta para formar uma proteína. (LODISH et al., 2014).
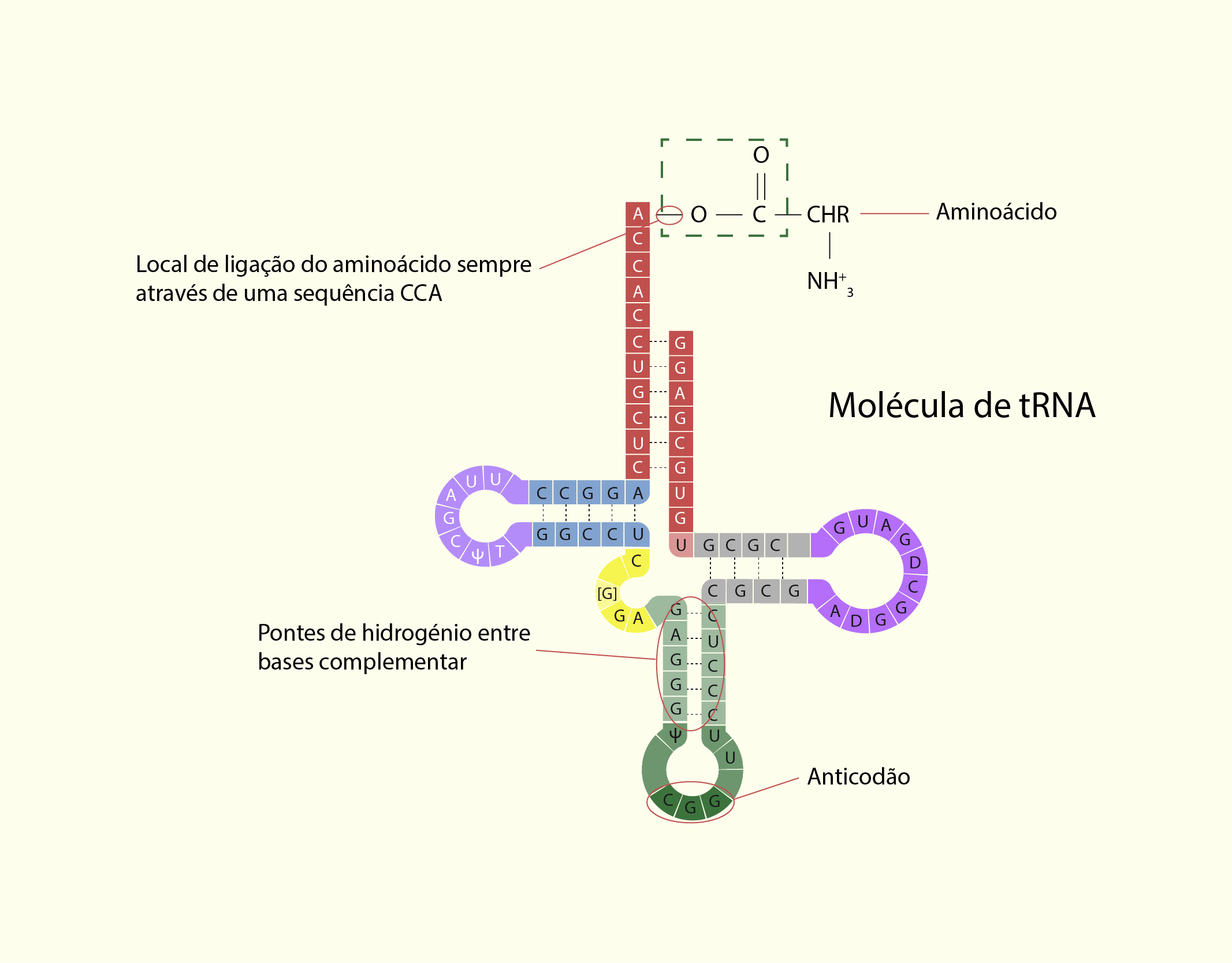
Além do mRNA e do rRNA para a síntese de uma proteína é necessária a participação do tRNA (RNA transportador ou de transferência), molécula de RNA responsável por transportar para os ribossomos os aminoácidos presentes no citosol na ordem ditada pelos nucleotídeos do mRNA e cada aminoácido é especificado por um códon no mRNA (Figura 2.16) (COOPER; HAUSMAN, 2007; DE ROBERTIS; HIB; 2016).
21629 Síntese de proteína em um ribossomo Fonte: Lodish et al. (2014, p. 131).
Para entendermos melhor como acontece o processo de tradução do RNA, precisamos entender o que é um códon, que se trata do código genético, lembrando que o DNA é formado por uma sequência de nucleotídeos que são representadas pelas letras: A (adenina), T (timina), C (citosina) e G (guanina), já no RNA, em vez da timina o nucleotídeo é uma uracila (U), sendo que A se liga a T ou U e C é complementar a G. As células utilizam a sequência de três desses nucleotídeos em diferentes combinações para formar um código e determinar um aminoácido correspondente. Por exemplo, a sequência AGU é um código que determina o aminoácido serina, a sequência GUA codifica para o aminoácido valina, assim, essas sequências de três nucleotídeos correspondem ao códon. Destas combinações, três códons não codificam aminoácidos (UAA, UGA e UAG) e são chamados de códons de parada que sinalizam o término da síntese da proteína. Além do códon de parada, há o códon de iniciação, o AUG que codifica para o aminoácido metionina (DE ROBERTIS; HIB, 2016).
Durante o processo de tradução do mRNA, cada um dos 20 aminoácidos deve ser alinhado com o seu códon correspondente. Isso é possível porque o tRNA (Figura 2.17) possui dois domínios de ligação, um que se liga de forma específica a um dos 20 aminoácidos e outro domínio chamado de anticódon, que consiste na sequência de três bases que são complementares às bases do códon do mRNA (COOPER; HAUSMAN, 2007; DE ROBERTIS; HIB; 2016).
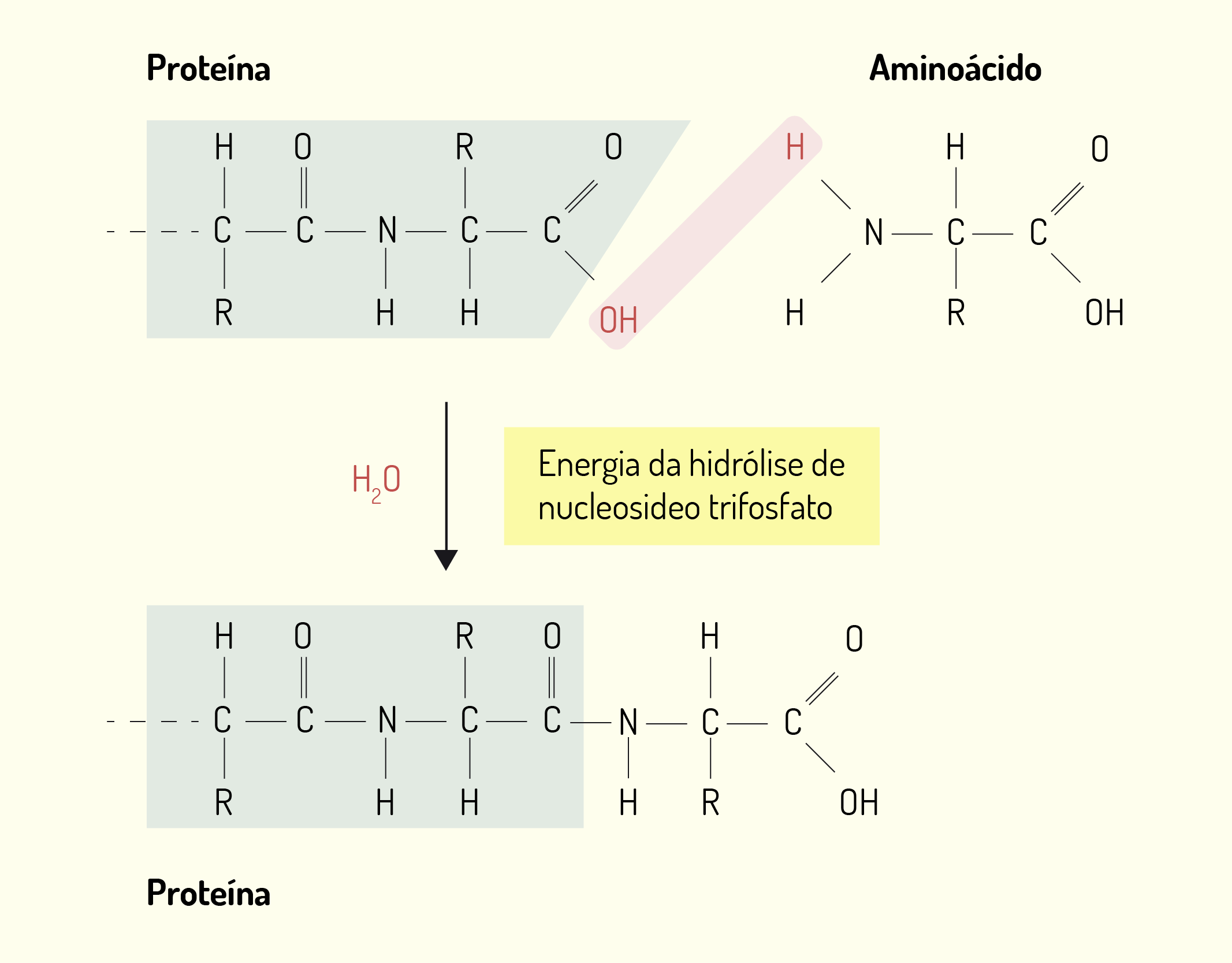
A ligação entre o aminoácido e o seu tRNA correspondente ocorre através de uma enzima chamada aminoacil-tRNA sintetase. As células possuem 20 aminoacil-tRNA, sendo que cada aminoácido reconhece seu tRNA correspondente. Os aminoácido são unidos através de ligações peptídicas para formar a proteína. Nesta ligação, o grupo carboxila de um aminoácido liga-se ao grupo amina do próxima aminoácido e com essa ligação ocorre a perda de uma molécula de água (H20). Desta forma, a proteína contém um grupo amina livre em uma extremidade, e um grupo carboxila em outra (DE ROBERTIS; HIB, 2016).
No primeiro passo na fase de iniciação da tradução do mRNA ocorre a ligação do tRNA iniciador e do mRNA à subunidade pequena do ribossomo, através de proteínas chamadas fatores de iniciação. Apenas o tRNA iniciador acoplado à metionina é capaz de ligar-se fortemente ao sítio P da subunidade pequena do ribossomo. O tRNA iniciador carregando a metionina é posicionado sobre a unidade pequena do ribossomo junto com proteínas chamadas fatores de iniciação. A subunidade pequena carregada liga-se à extremidade 5’ de uma molécula de mRNA, desta forma, a subunidade pequena move-se ao longo mRNA à procura do códon de iniciação AUG. Assim que o códon AUG é encontrado, vários fatores de iniciação dissociam-se da subunidade pequena do ribossomo, de forma a liberar espaço para que a subunidade grande possa associar-se à subunidade pequena e completar a montagem do ribossomo completo. Desta forma, com o tRNA ligado ao sítio P, a síntese da proteína está pronta para começar, com a adição do próximo tRNA carregado no sítio A (ALBERTS; WALTER, 2011).
Na fase de alongamento, os aminoácidos são adicionados na cadeia polipeptídica. O sítio P está ocupado pelo tRNA iniciador, em seguida, um tRNA acoplado com o aminoácido correto liga-se ao sítio A pareando com o códon exposto no sítio A. Em seguida, o aminoácido do sítio P é liberado e ligado ao sítio A, essa reação é catalisada por uma enzima chamada peptil-transferase. Esse ciclo vai se repetindo e o ribossomo vai se deslocando pelo mRNA. O tRNA que estava ligado ao sítio P é deslocado para o sítio A, da mesma forma que o tRNA que estava no sítio A passa a ocupar o sítio P, permitindo que o sítio A fique livre para a entrada do próximo tRNA acoplado ao aminoácido (DE ROBERTIS, HIB, 2016).
No término da tradução, o processo é sinalizado por algum dos códons de parada (UAA, UAG e UGA) que não são reconhecidos pelo tRNA e, desta forma, não determinam nenhum aminoácido. Isso sinaliza para o término da tradução para o ribossomo. A partir desse momento, proteínas chamadas de fatores de liberação ligam-se ao sítio A do ribossomo em qualquer códon. Essa ligação provoca alterações que fazem com que o ribossomo libere o mRNA e a dissociação das duas subunidades ribossômicas, que poderão unir-se novamente sobre outra molécula de mRNA para dar início a síntese de outra proteína (ALBERTS; WALTER, 2011).
Fique por dentro
Síntese Proteica
Neste tópico falamos sobre como as proteínas são sintetizadas e vimos que este processo envolve diferentes tipos de RNAs como os mRNAs, rRNAs e os tRNAs. Para entendermos melhor este processo, segue o link abaixo com um vídeo curto, ilustrando melhor como acontece a síntese das proteínas que ajudará você a compreender melhor este conteúdo. www.youtube.com
Atividades
Com relação ao processo de síntese das proteínas é correto o que se afirma em:
- O código genético expressa-se através de códons, que consistem em uma sequência de três lipídios.
O código genético é expresso através dos códons, no entanto, um códon consiste em uma sequência de três bases nitrogenadas e não por lipídeos.
- O mRNA é a molécula de RNA que contém a informação para a produção das proteínas.
No processo de tradução, a sequência de nucleotídeos de um mRNA é utilizada como molde para unir os aminoácidos na ordem correta para formar uma proteína.
- Alguns códons não codificam proteínas e são chamados códons de iniciação.
alguns códons (UAA, UAG e UGA) não codificam proteínas, no entanto, são chamados códons de parada. Isso porque o não são reconhecidos e desta forma sinalizam o término da síntese da proteína.
- O mRNA é responsável por transportar os aminoácidos até os ribossomos.
o mRNA é a molécula que contém a informação para a produção das proteínas, que faz o transporte dos aminoácidos até os ribossomos.
- O sítio A é o local de entrada do tRNA iniciador no início da tradução.
o local de entrada do tRNA iniciador é o sítio P. O sítio A é o local onde ocorre a entrada dos outros tRNA acoplados a aminoácidos.
Mitose e Meiose
Uma propriedade fundamental das células é a capacidade de se reproduzir. Uma célula se reproduz duplicando seu conteúdo e, então, divide-se. Essas etapas de duplicação e divisão celular são conhecidas como ciclo celular e esse é o principal mecanismo pelo qual os seres vivos se reproduzem. No começo desta unidade falaremos sobre a mitose e, a seguir, falaremos sobre a meiose. Os detalhes da mitose podem variar de um organismo para o outro, no entanto, certas características são universais, como copiar e passar para as próximas gerações a informação genética (JOHNSON; WALTER, 2011; DE ROBERTIS; HIB, 2016).
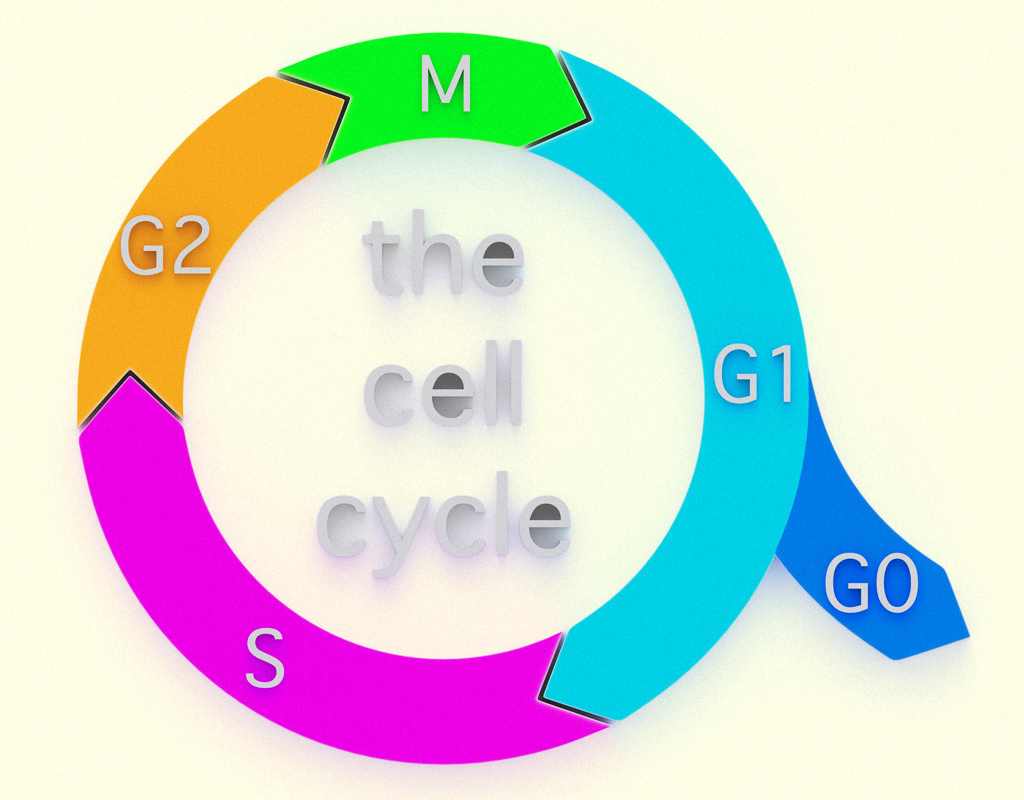
O ciclo celular é dividido em quatro fases sucessivas: G1, S, G2 e M. A fase M corresponde a mitose, período em que o núcleo celular divide-se (mitose) e a célula divide-se em duas sendo este último processo chamado citocinese. Juntos, esses dois processos constituem a fase M. O período entre a fase M e a próxima fase é chamado interfase e compreende três fases restantes do ciclo celular: a fase S (síntese), que é precedida pela fase G1 (g = gap, intervalo) e, após a fase S ocorre a fase G2. A fase S corresponde à etapa em que a célula duplica o seu DNA nuclear. A fase G1 é o intervalo entre a fase M e o início da fase S. A fase G2 é o intervalo entre a fase S e a fase M (Figura 2.18) (JOHNSON; WALTER, 2011; DE ROBERTIS; HIB, 2016).
21829 Fases do ciclo celular Fonte: LUC COX, 123RF.
A duração do ciclo celular é variável conforme o tipo de célula, sendo a G1 a fase mais variável que pode durar dias, meses ou até anos. Células que não se dividem como, por exemplo, as células nervosas, permanecem no ciclo G1, desta forma, essas células saem do ciclo celular e nesse caso é denominado G0 (DE ROBERTIS; HIB, 2016).
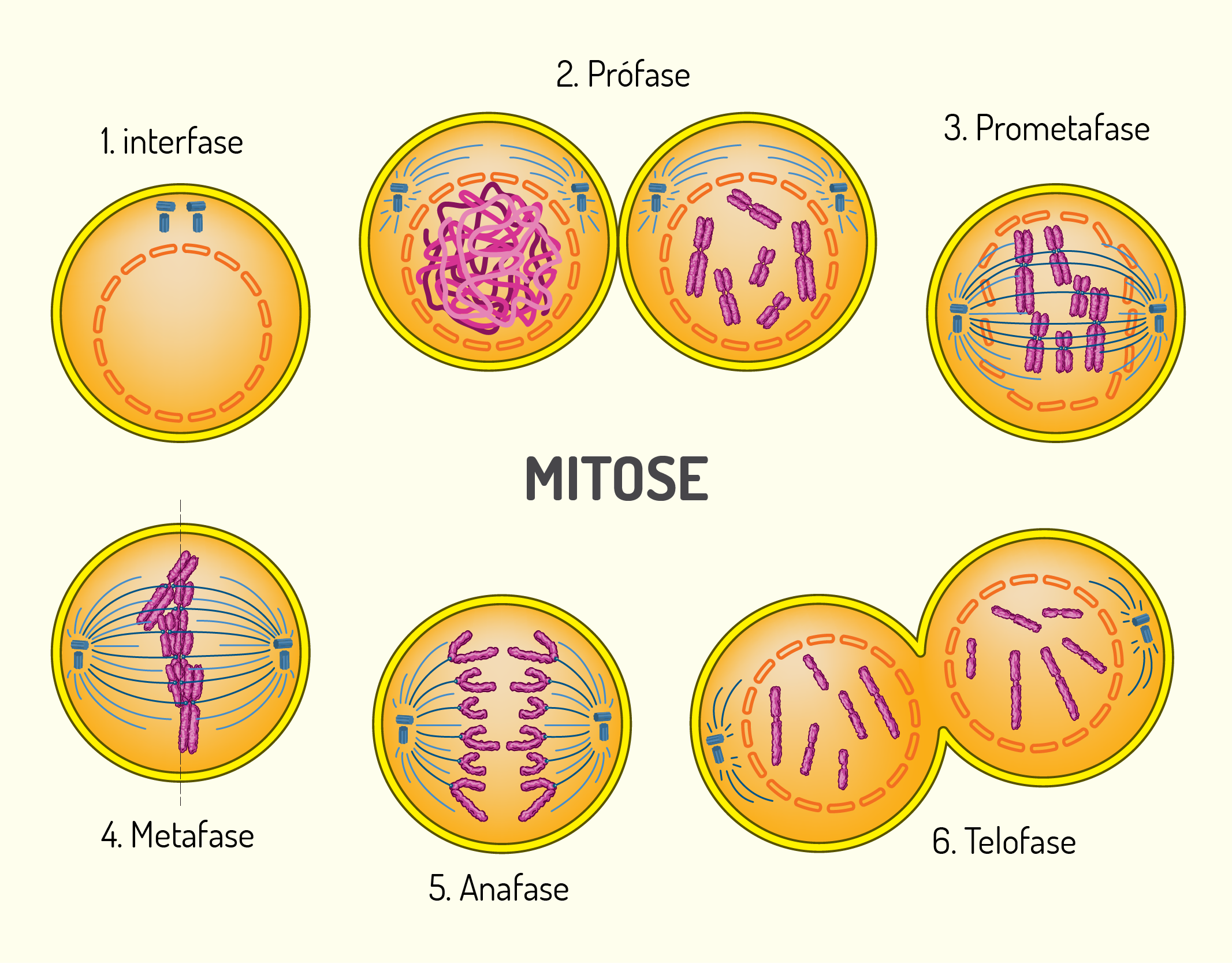
A divisão celular compreende mecanismos em que as células duplicam seu conteúdo e, em seguida, são distribuídos de modo que cada célula-filha receba proporções, teoricamente iguais. Nesse processo, não apenas o material genético é duplicado, além deste, todos os componentes da célula também são duplicados. Geralmente, as etapas que originam a mitose são semelhantes nas diversas células do organismo. Na Figura 2.19 estão representadas as fases da mitose que compreendem a prófase, a prometáfase, a metáfase, a anáfase e a telófase. Na anáfase, tem início o processo de divisão da célula, que termina quando a telófase está concluída. Esse processo de divisão é chamado citocinese (DE ROBERTIS; HIB, 2016).
21929 Esquema geral das fases da mitose Fonte: LUKAVES, 123RF.
Prófase: após a duplicação do DNA na fase S, os cromossomos condensam-se. Nesta fase, cada cromossomo consiste em 2 moléculas de DNA, chamadas de cromátides-irmãs, que são mantidas unidas pelo centrômero, uma sequência de DNA que se associa à proteínas para formar o cinetócoro. Ainda nesta fase, ocorre a formação do fuso mitótico, que são feixes de microtúbulos que surgem de ambos centrossomos. Estes são estruturas situadas ao lado do núcleo, local de onde as fibras do fuso irradiam em direção ao centro da célula (JOHNSON; WALTER, 2011; DE ROBERTIS; HIB, 2016).
A Prometáfase corresponde à fase de transição entre a prófase e a metáfase. Nesta fase, o envoltório nuclear desintegra-se. Algumas fibras do fuso, através de suas extremidades livres conectam-se ao cinetócoro. Essas fibras são chamadas cinetocórias. Os cromossomos ligados pelas fibras do fuso são puxados até se alinharem no centro da célula. Nesta fase, a célula atinge a metáfase (JOHNSON; WALTER, 2011; DE ROBERTIS; HIB, 2016).
Metáfase: grande parte das células permanecem pouco tempo na metáfase. Nesta fase, os cromossomos estão no seu grau máximo de condensação e alinhados no centro da célula para formar a placa equatorial (DE ROBERTIS; HIB, 2016).
Anáfase: nesta fase, ocorre a quebra da ligação entre as cromátides-irmãs, desta forma, os cromossomos-filhos ficam separados e começam a se deslocar para os pólos opostos do fuso, sendo puxados pelas fibras do fuso. Além disso, os cromossomos apresentam-se com um formato que lembra a letra V (DE ROBERTIS; HIB, 2016).
Telófase: nesta fase, os cromossomos-filhos estão totalmente separados. Assim que estes chegam aos pólos, ocorre o desaparecimento das fibras do fuso. Nesta fase, os cromossomos descondensam-se e convertem-se à cromatina desenrolada, que estão rodeadas por algumas partes do RE, associando-se até formar os envoltórios nucleares dos dois núcleos filhos (DE ROBERTIS; HIB, 2016).
À partir da anáfase começa o processo de citocinese, pelo qual a célula divide-se e dá origem à duas células-filhas. Nesse processo ocorre a formação de sulcos na superfície da célula, que leva ao estreitamento do citoplasma na região equatorial, e este sulco vai se aprofundando conforme a célula se divide. A ponte entre as duas células filhas é rompida, o citoesqueleto é restabelecido e, por fim, as células-filhas adquirem o formato original da célula antecessora, completando o processo (DE ROBERTIS; HIB, 2016).
Todo esse processo que acabamos de discutir trata-se da mitose. À seguir falaremos sobre a meiose. Ao contrário da mitose, na meiose a célula parental diplóide divide-se dando origem a células haplóides, ou seja, a célula-filha possui apenas um membro do par de cromossomos homólogos que estavam presentes na célula parental. Esse tipo de divisão ocorre em organismos que se reproduzem de forma sexuada. Na maioria dos organismos multicelulares, a reprodução ocorre através dos gametas que foram gerados por meiose, onde o gameta masculino e feminino se unem em um processo chamado fecundação (COOPER; HAUSMAN, 2007).
Meiose
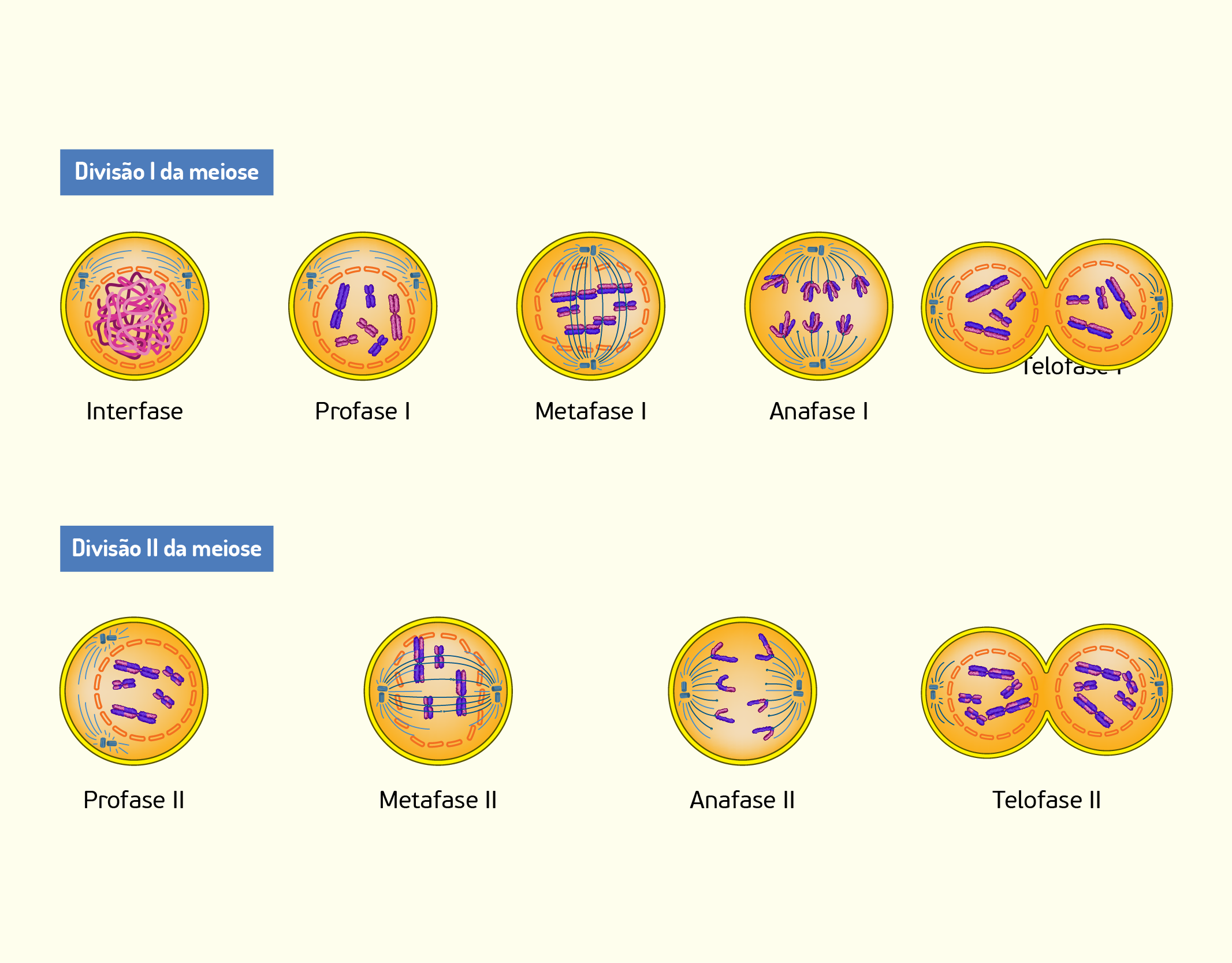
A meiose é um processo muito importante em organismos que se reproduzem sexuadamente, pois as células germinativas que originam as células reprodutivas femininas e masculinas, ou seja, os gametas haplóides (n), surgem à partir desse processo especial de divisão celular. A meiose também é a grande responsável pela variabilidade genética existente entre os indivíduos e ocorre em duas etapas distintas, a meiose I e a meiose II (Figura 2.20). Assim como ocorre na mitose, a meiose I e II são divididas em prófase, metáfase, anáfase, telófase e citocinese (COOPER; HAUSMAN, 2014; DE ROBERTIS, HIB, 2016). À seguir, descreveremos cada uma dessas etapas.
Meiose I
Essa é a etapa em que uma célula diplóide (2n) divide-se formando duas células, também diplóides, e, por isso, é chamada de divisão equacional (COOPER; HAUSMAN, 2014; DE ROBERTIS, HIB, 2016).
Prófase I
É a fase mais longa e complicada da meiose I, pois possui 5 estágios distintos (Leptóteno, Zigóteno, Paquíteno, Diplóteno e Diacinese) e começa quando os cromossomos já estão duplicados e, consequentemente, cada um deles consiste em duas cromátides irmãs; À seguir estão descritos cada um dos cinco estágios da prófase I:
- Leptóteno: nesta fase, os cromossomos duplicados ainda apresentam-se como filamentos finos e condensam-se no emaranhado difuso da cromatina. À medida que a condensação cromossômica continua, a célula progride para o zigóteno (COOPER; HAUSMAN, 2014; DE ROBERTIS, HIB, 2016).
- Zigóteno: nesta fase, inicia-se o pareamento preciso dos cromossomos homólogos paterno e materno, mediado por um complexo proteico, o complexo sinaptonêmico. Os homólogos unidos por esse complexo, formam cromossomos BIVALENTES ou tétrade de cromátides, ou seja, dois cromossomos homólogos com 2 cromátides irmãs (COOPER; HAUSMAN, 2014; DE ROBERTIS, HIB, 2016).
- Paquíteno: no paquíteno, a sinapse entre os homólogos está completa e as cromátides estão em posição favorável para permitir o crossing-over, que é a troca de segmentos entre cromátides não-irmãs do par de cromossomos homólogos, responsável pela variabilidade genética dos gametas formados na meiose (COOPER; HAUSMAN, 2014; DE ROBERTIS, HIB, 2016).
- Diplóteno: os cromossomos estão mais visíveis e os bivalentes começam a se repelir até que os cromossomos homólogos separam-se e o complexo sinaptonêmico desaparece. Porém, os centrômeros permanecem unidos e o conjunto de cromátides-irmãs continua ligado pelos quiasmas que se tornam visíveis nessa fase (COOPER; HAUSMAN, 2014; DE ROBERTIS, HIB, 2016).
- Diacinese: na diacinese, os cromossomos atingem condensação máxima, a membrana nuclear e o núcleo desaparecem e os microtúbulos ligam-se aos centrômeros dos cromossomos bivalentes e estão prontos para a metáfase I (COOPER; HAUSMAN, 2014; DE ROBERTIS, HIB, 2016).
Após a prófase I, tem início a metáfase I.
Metáfase I
Os Cromossomos bivalentes encontram-se, então, pareados no plano equatorial com seus centrômeros orientados para os pólos opostos da célula (COOPER; HAUSMAN, 2014; DE ROBERTIS, HIB, 2016).
Anáfase I
Os cromossomos homólogos separam-se e migram para os pólos opostos da célula. O número de cromossomos portanto, é reduzido pela metade e os conjuntos materno e paterno originais são separados em combinações aleatórias. Essa é a fase mais propensa a erros chamados de não-disjunção, no qual um par de homólogos pode migrar para o mesmo pólo da célula e gerar consequências graves (COOPER; HAUSMAN, 2014; DE ROBERTIS, HIB, 2016).
Telófase I
Os dois conjuntos haplóides (n) de cromossomos formados na anáfase I agrupam-se nos pólos opostos da célula. Ocorre, novamente, a reorganização do nucléolo, a descondensação da cromatina e a formação do envoltório nuclear. A telófase é seguida pela reorganização nuclear, o citoplasma da célula é dividido de modo igual entre as duas células-filhas haplóides (n) e as células estão prontas para a meiose II (COOPER; HAUSMAN, 2014; DE ROBERTIS, HIB, 2016).
Meiose II
É semelhante à mitose, porém não há duplicação do DNA antes da divisão celular e o resultado final é a formação de quatro células haplóides (n), os gametas, sendo, por esse motivo, uma divisão reducional(COOPER; HAUSMAN, 2014; DE ROBERTIS, HIB, 2016).
Prófase II
A cromatina se torna mais compactada, ocorre o desaparecimento da membrana nuclear e os microtúbulos ligam-se aos cinetócoros e começam a mover os cromossomos para o centro da célula (COOPER; HAUSMAN, 2014; DE ROBERTIS, HIB, 2016).
Metáfase II
Os cromossomos tornam-se dispostos na placa equatorial metafásica, onde permanecem ligados às fibras do fuso por meio dos centrômeros das cromátides-irmãs, que ficam voltadas cada uma para um pólo (COOPER; HAUSMAN, 2014; DE ROBERTIS, HIB, 2016).
Anáfase II
O evento característico dessa fase é a separação das cromátides-irmãs, que ao serem puxadas pelas fibras do fuso, migram para pólos opostos da célula. A não-disjunção das cromátides-irmãs também pode causar consequências graves, causadoras de aberrações cromossômicas em humanos (COOPER; HAUSMAN, 2014; DE ROBERTIS, HIB, 2016).
Telófase II
Após atingirem os pólos, os cromossomos descondensam-se, novamente, e um novo envoltório nuclear é reorganizado em torno de cada conjunto de cromossomos. Citocinese: o citoplasma da célula é dividido e quatro células, com número de cromossomos haplóides, ou seja, quatro gametas diferentes, são formados (COOPER; HAUSMAN, 2014; DE ROBERTIS, HIB, 2016).
Reflita
A meiose é um processo que, geralmente, ocorre em organismos que se reproduzem de maneira sexuada. No entanto, algumas falhas de distribuição dos cromossomos, durante o processo de divisão podem ocorrer e essas falhas podem ter consequências graves na espécie humana. Esta falha na distribuição dos cromossomos é chamada de não-disjunção, onde, ao final do processo, os gametas gerados podem conter cromossomos a mais ou a menos. Este tipo de erro é conhecido como aberração cromossômica numérica e, corresponde à causa de várias síndromes como, por exemplo, a Síndrome de Down, onde os seus portadores possuem um cromossomo 21 a mais. Indivíduos com Síndrome de Down apresentam retardo mental, desenvolvimento anormal da face, dentre outras consequências.
Atividades
Mitose e meiose são processos de divisão celular que, ocorrem em situações diferentes em um organismo. Esses processos envolvem replicação e distribuição do DNA entre as células filhas (mitose) ou germinativas (meiose). Considerando os processos de mitose e meiose, analise as afirmativas abaixo e julgue o que for CORRETO:
- A mitose é um processo de divisão celular responsável pela variabilidade genética.
O processo de meiose é o grande responsável pela variabilidade genética existente entre os indivíduos, através de um mecanismo chamado crossing-over, que consiste na troca de segmentos entre as cromátides não-irmãs do par de cromossomos homólogos.
- O ciclo celular é dividido em quatro fases sucessivas: G1, S, G2 e M.
O ciclo celular é dividido em quatro fases sucessivas: G1, S, G2 e M. A fase M corresponde à mitose, período em que o núcleo celular divide-se e a célula divide-se. O período entre a fase M e a próxima fase é chamado interfase e compreende três fases restantes do ciclo celular, a fase S (síntese), que é precedida pela fase G1 (g = gap, intervalo) e, após a fase S ocorre a fase G2.
- As células germinativas surgem do processo de mitose.
A meiose é um processo muito importante em organismos que se reproduzem sexuadamente, pois as células germinativas que originam as células reprodutivas femininas e masculinas, surgem à partir desse processo especial de divisão celular.
- A prófase é o estágio em que os cromossomos se encontram no nível máximo de condensação.
Os cromossomos se encontram no nível máximo de condensação na fase de metáfase.
- Durante a meiose I, na prófase I, a fase em que os cromossomos se encontram no nível máximo de condensação é o leptóteno.
A fase em que os cromossomos estão no nível máximo de condensação corresponde à diacinese. Na fase de leptóteno, os cromossomos duplicados ainda apresentam-se como filamentos finos e condensam-se no emaranhado difuso da cromatina.
Histologia: tecido cartilaginoso e muscular
No decorrer desta unidade falamos sobre a célula, sobre seus componentes, sua estrutura, sobre a divisão celular e conhecemos o processo de produção das proteínas, essas macromoléculas multifuncionais. A célula é a unidade básica de um ser vivo e é a menor unidade capaz de realizar processos que estão relacionados com a vida. O corpo humano possui bilhões de células e cada célula realiza uma função especializada, além das atividades básicas exigidas de todas as células, sendo que as funções celulares básicas são essenciais para a sobrevivência da célula, enquanto as funções especializadas e interações com outras células são fundamentais para a sobrevivência de todo o organismo. Para que as células possam realizar processos de sustentação da vida do organismo, como respiração e digestão, elas precisam estar organizadas. Desta forma, as células que possuem estrutura semelhante e com determinada função especializada são organizadas em tecidos. O corpo humano é formado por diversos tecidos como tecido epitelial, conjuntivo, adiposo, cartilaginoso, ósseo, nervoso e muscular (SHERWOOD, 2011).
Neste tópico, abordaremos os tecidos cartilaginoso e muscular. O tecido cartilaginoso, juntamente com o tecido ósseo, participa da sustentação do corpo. Esse tecido é formado por células chamadas condrócitos, que ocupam cavidades da matriz extracelular chamadas lacunas. A cartilagem também reveste as superfícies articulares onde absorve choques e são fundamentais para a formação dos ossos longos. A matriz da cartilagem é composta por colágeno ou colágeno mais elastina, associados a proteoglicanas (proteínas + glicosaminoglicanas) e glicoproteínas adesivas. Além disso, a cartilagem é desprovida de vasos sanguíneos, linfáticos e nervos. Desta forma, as células do tecido cartilaginoso recebem nutrientes através de vasos sanguíneos do tecido conjuntivo que as envolve, sendo esta região chamada de pericôndrio. Regiões onde a cartilagem não se encontra envolvida pelo pericôndrio, recebe nutrição do líquido sinovial que banha as superfícies articulares. As cartilagens se diferenciam por três tipos: cartilagem hialina, cartilagem elástica e cartilagem fibrosa (JUNQUEIRA; CARNEIRO, 2013).
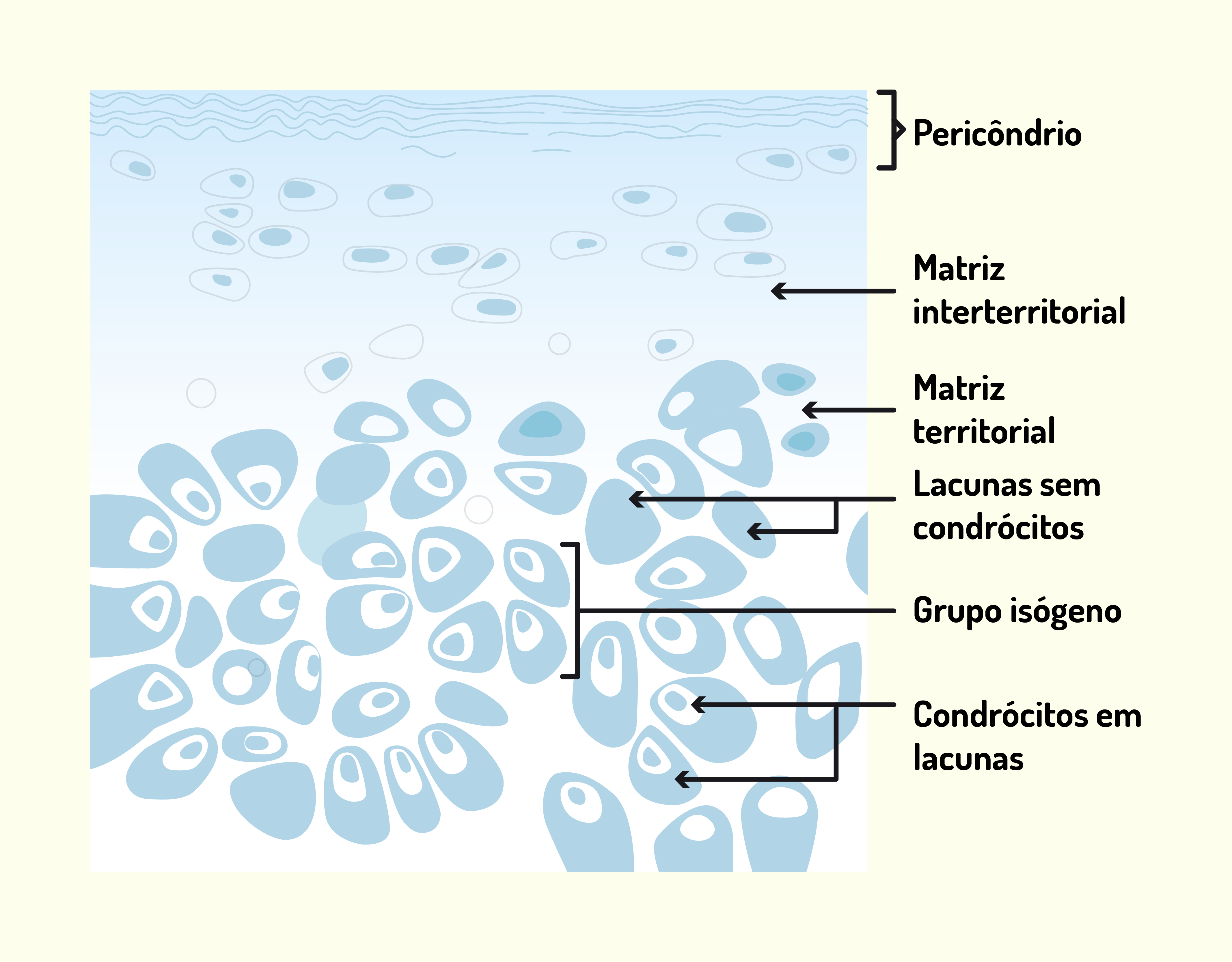
A cartilagem hialina (Figura 2.21) é o tipo de cartilagem mais abundante no corpo. Possui uma tonalidade branco-azulada e translúcida. Este tipo de cartilagem forma o primeiro esqueleto do embrião que, mais tarde, é substituído pelos ossos. Em adultos, é encontrada nas paredes das fossas nasais, traquéia, brônquios e recobrindo as superfícies articulares de ossos longos. São formadas por fibrilas de colágeno tipo II em associação com proteoglicanas e glicoproteínas. Além disso, a cartilagem hialina também é formada por uma glicoproteína estrutural chamada condronectina, que possui sítios de ligação para condrócitos, fibrilas colágenas tipo II e glicosaminoglicanos. Desta forma, as condronectinas associam os elementos macromoleculares da matriz com os condrócitos (JUNQUEIRA; CARNEIRO, 2013).
22129 Cartilagem hialina Fonte: Gartner; Hiatt (2007, p. 134).
Na região onde a cartilagem será formada, as células mesenquimais (células multipotentes formadas à partir do mesoderma, folheto intermediário do embrião) diferenciam-se em condroblastos e iniciam a típica secreção de matriz cartilaginosa em torno de si mesmos. Esse processo de secreção chega a tal ponto que o condroblasto fica envolvido por essa matriz que ele mesmo secretou. Desta forma, o condroblasto fica enclausurado em pequenos compartimentos que são chamados de lacunas. Uma vez envolvidos por essa matriz, o condroblasto passa a ser chamado de condrócito que, por sua vez, divide-se e forma grupos de células dentro da mesma lacuna, chamados de grupo isógeno. Conforme as células do grupo isógeno se reproduzem, elas vão se afastando e formando lacunas individuais, o que aumenta a cartilagem de dentro para fora. Esse tipo de crescimento é chamado de crescimento intersticial e ocorre nas primeiras fases de vidas da cartilagem. A cartilagem também apresenta crescimento aposicional, onde as células do pericôndrio multiplicam-se e diferenciam-se em condrócito. Em estágio de crescimento, a região superficial das cartilagens apresenta transições entre células do pericôndrio e condrócitos. Nos dois tipos de crescimento, assim que formados, os condrócitos produzem fibrilas colágenas, proteoglicanas e glicoproteínas (JUNQUEIRA; CARNEIRO, 2013).
Quando comparada a outros tecidos, o tecido cartilaginoso é, relativamente, mais sujeito a processos degenerativos, onde o processo mais comum é a calcificação da matriz. Quando a cartilagem sofre alguma lesão, é regenerada com dificuldade e, geralmente, não é de forma completa, com exceção em crianças. Em adultos, a regeneração é realizada pela atividade do pericôndrio, no entanto, se a lesão for muito extensa, uma cicatriz de tecido conjuntivo é formada, ao invés de um novo tecido cartilaginoso (JUNQUEIRA; CARNEIRO, 2013).
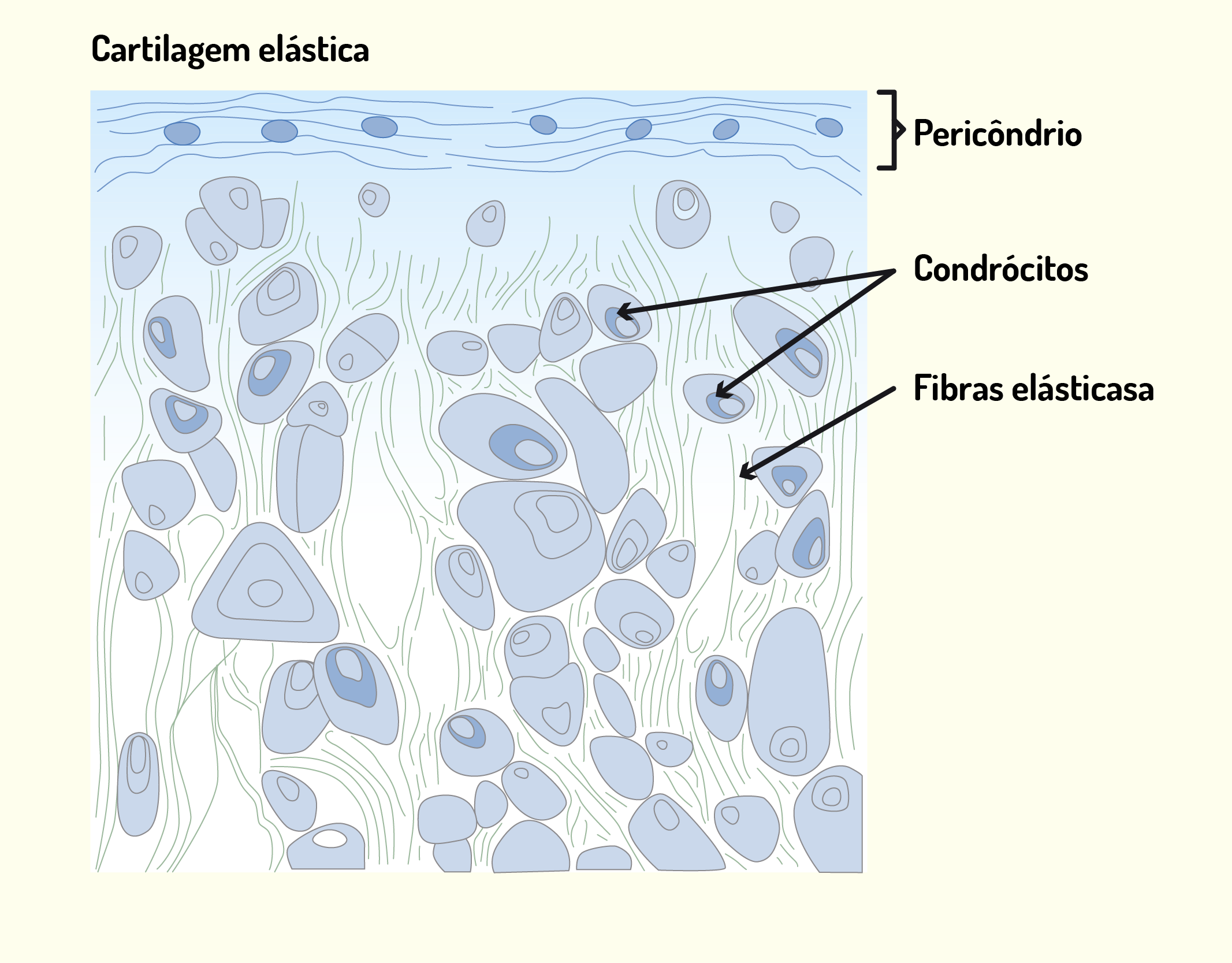
A cartilagem elástica (Figura 2.22) é semelhante à cartilagem hialina, que além das fibrilas colágenas do tipo II, são constituídas por uma rede de fibras elásticas finas, que conferem a esta cartilagem uma tonalidade amarela. Este tipo de cartilagem é encontrado em regiões como a epiglote e a tuba auditiva. A cartilagem elástica cresce, principalmente, por aposição, possui pericôndrios e é menos sujeita a processos degenerativos quando comparada com a cartilagem hialina (JUNQUEIRA; CARNEIRO, 2013).
22229 Cartilagem elástica Fonte: Gartner; Hiatt (2007, p. 134).
A cartilagem fibrosa, também chamada de fibrocartilagem, é encontrada nos discos intervertebrais, nos pontos onde alguns tendões e ligamentos se inserem nos ossos e, também, na sínfise pubiana. Este tipo de cartilagem apresenta características intermediárias entre o tecido conjuntivo denso e a cartilagem hialina (Figura 2.23). As fibras colágenas do tipo I constituem feixes, que possuem orientação irregular entre os condrócitos ou dispostas paralelamente aos condrócitos, em fileiras. Este tipo de cartilagem não possui pericôndrio (JUNQUEIRA; CARNEIRO, 2013).
22329 Cartilagem fibrosa Fonte: Gartner; Hiatt (2007, p. 134).
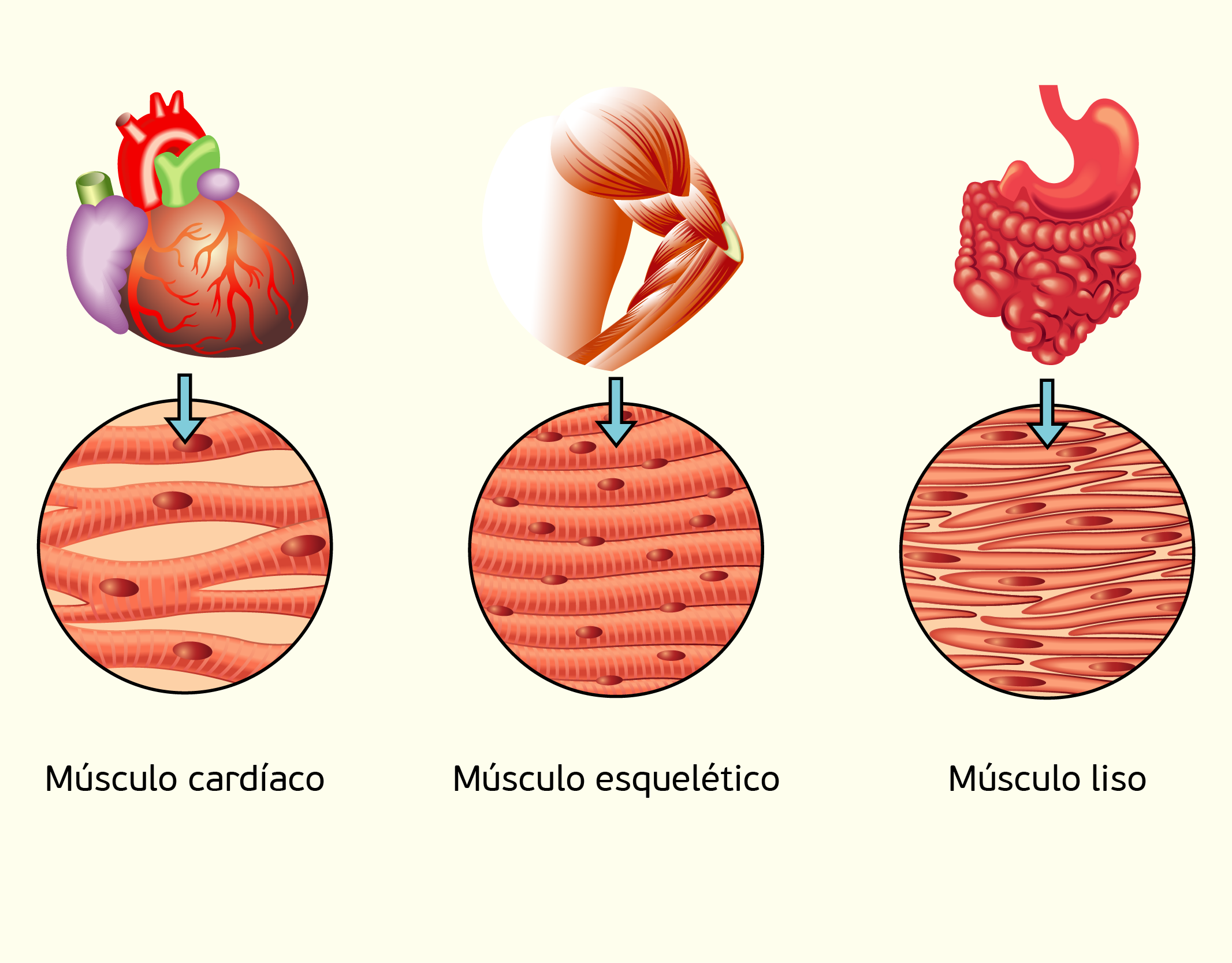
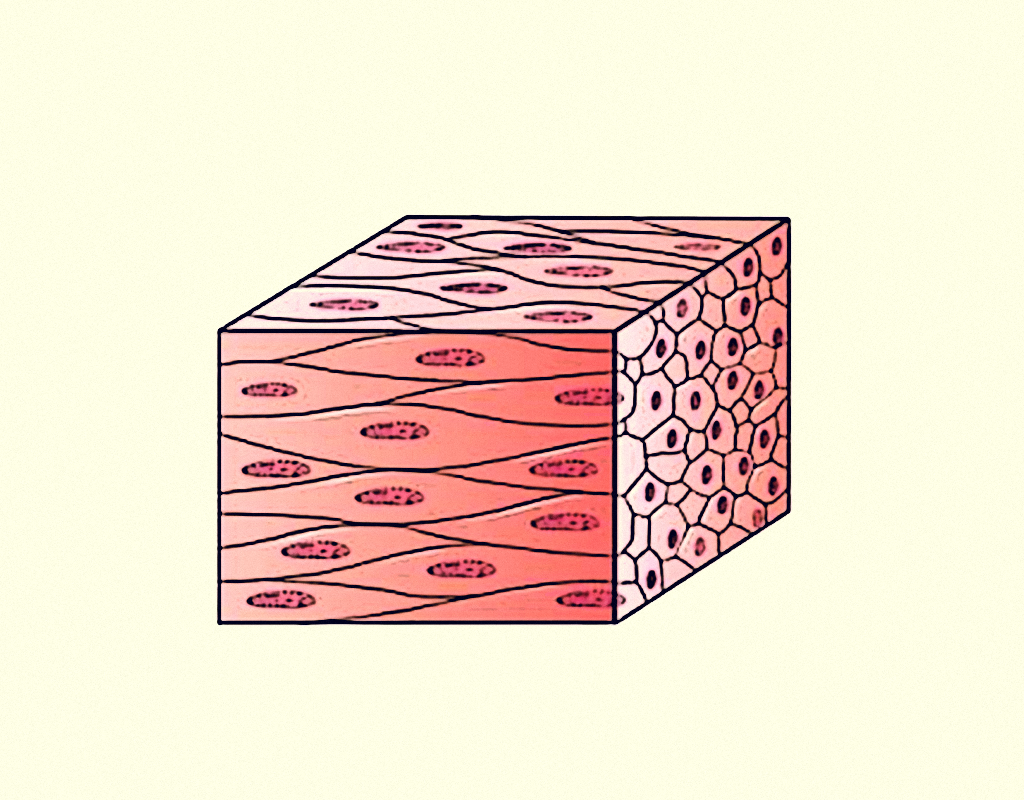
Agora que conhecemos sobre o tecido cartilaginoso, falaremos, a seguir, sobre o tecido muscular. Este tecido é constituído por células muito alongadas e que contêm grande quantidade de filamentos citoplasmáticos. Além disso, essas células são especializadas na contração, que gera tensão e produz movimento. Existem três tipos de tecido muscular: o músculo liso, que controla movimentos como dos alimentos ao longo do trato digestório, o músculo estriado esquelético, que move o esqueleto e o músculo estriado cardíaco, que apresenta contração involuntária e rítmica e está envolvido com o bombeamento de sangue, à partir do coração. A membrana das células musculares é chamada de sarcolema, já, o citoplasma de sarcoplasma e o retículo endoplasmático liso de sarcoplasmático. As estruturas dos três tipos de tecidos muscular estão representadas na Figura 2.24 (SHERWOOD, 2011; JUNQUEIRA; CARNEIRO, 2013):
22429 Estruturas dos diferentes tipos de tecido muscular Fonte: Junqueira; Carneiro (2013, p. 178).
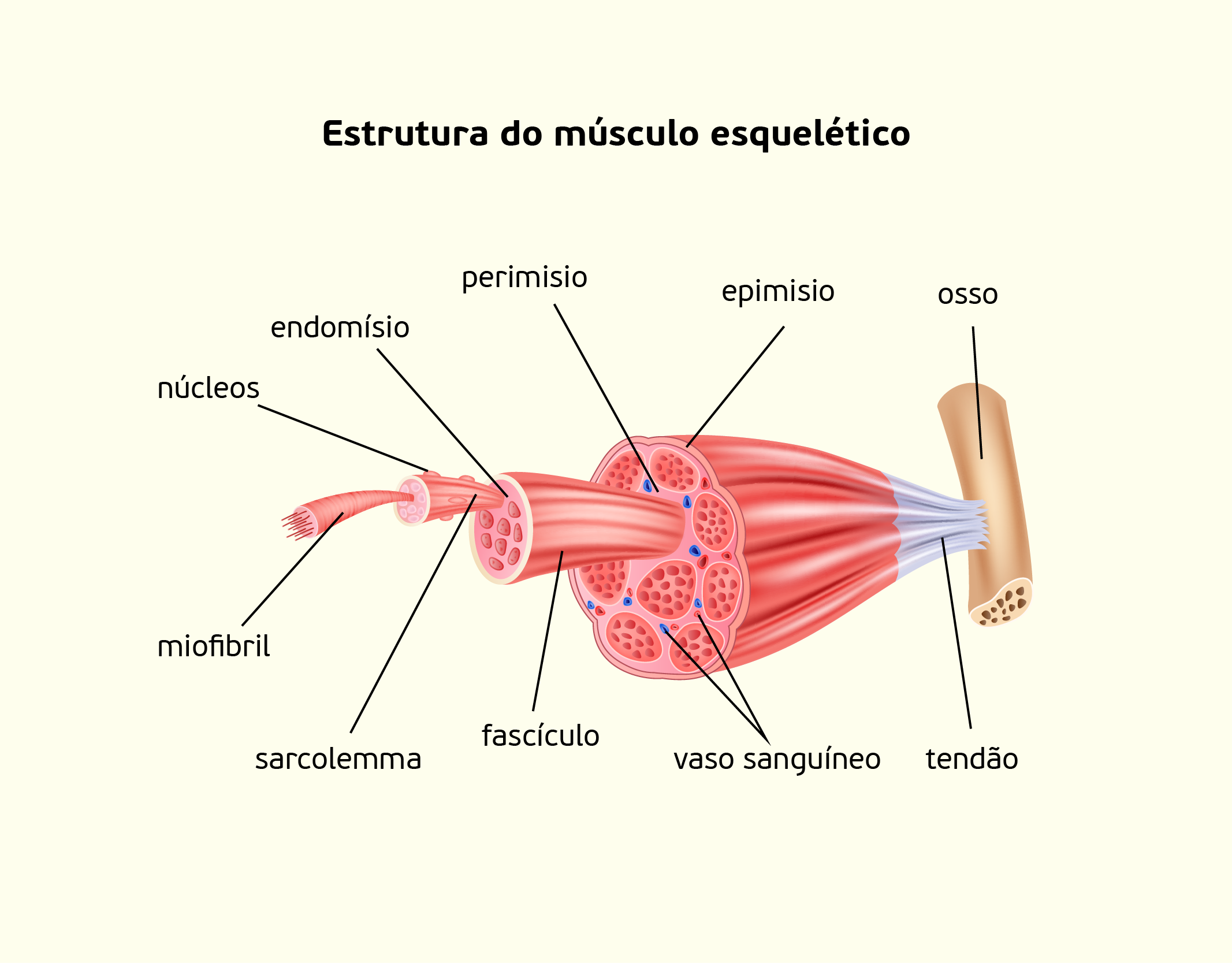
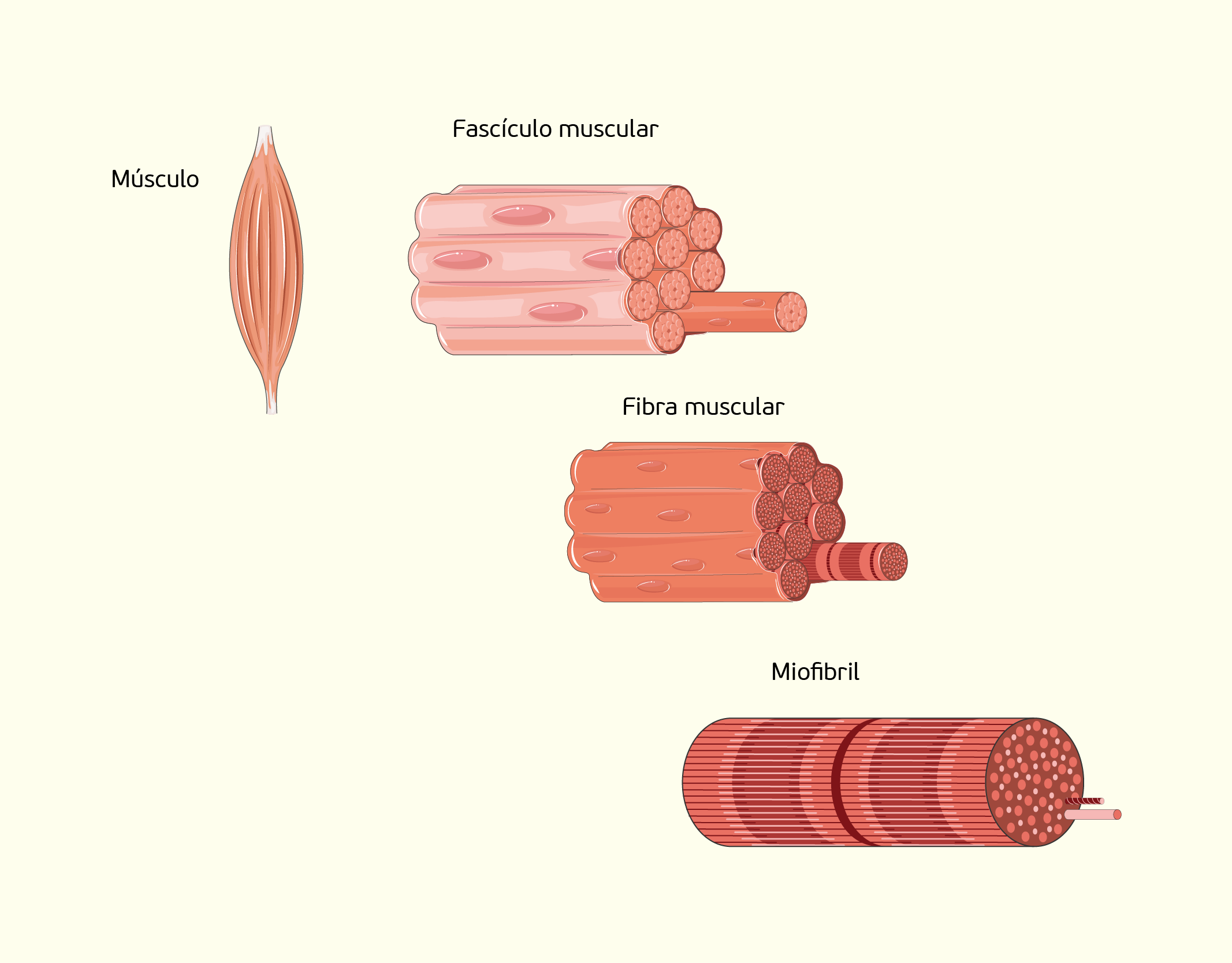
As células que formam o tecido muscular esquelético são longas, cilíndricas, multinucleadas e com muitos filamentos, as miofibrilas, que, por sua vez, são formadas por arranjos de miofilamentos (estruturas proteicas responsáveis pela capacidade de contração da célula). Os numerosos núcleos ficam na periferia das fibras, próximos ao sarcolema. Diferente do tecido muscular cardíaco, onde seus núcleos são centrais, essa característica ajuda a diferenciar os dois tecidos, visto que ambos possuem estriações transversais. Uma única célula do músculo esquelético é chamada fibra muscular, e estas estão dispostas paralelamente entre si e agrupadas por tecido conectivo, formando os músculos. O tecido muscular recobre o esqueleto e está preso aos ossos por meio de filamentos resistentes chamados de tendões. Estes são constituídos pela extremidade do tecido fibroso que reveste os músculos (JUNQUEIRA; CARNEIRO, 2013).
22529 Organização do tecido muscular esquelético Fonte: TEGUH MUJIONO, 123RF.
Em músculos como o bíceps, as fibras musculares agrupam-se em feixes, onde o conjunto de feixes é envolvido por uma camada de tecido conectivo chamada de epimísio que cobre todo o músculo (Figura 2.25). Os feixes de fibras musculares são envolvidas pelo perimísio e cada uma delas é envolvida pelo endomísio (SHERWOOD, 2011; JUNQUEIRA; CARNEIRO, 2013).
Quando observadas ao microscópio óptico, as fibras musculares exibem faixas escuras chamadas bandas A e claras chamadas bandas I, que se alternam (Figura 2.26). Essas bandas, dispostas paralelamente, produzem a aparência estriada das fibras musculares. Filamentos finos e grossos alternados que se sobrepõem são responsáveis pelas bandas A e I. A banda A apresenta um linha clara na região central chamada de linha H e a banda I é dividida por uma linha escura chamada de linha Z. A área entre duas linhas Z é conhecida como sarcômero. O sarcômero é uma estrutura cilíndrica delimitada por duas placas proteicas, ou seja, a linha Z e é a unidade funcional do músculo esquelético (SHERWOOD, 2011; GARTNER; HIATT, 2007).
22629 Estrutura das fibras musculares e sarcômero Fonte: Junqueira; Carneiro (2013, p. 184).
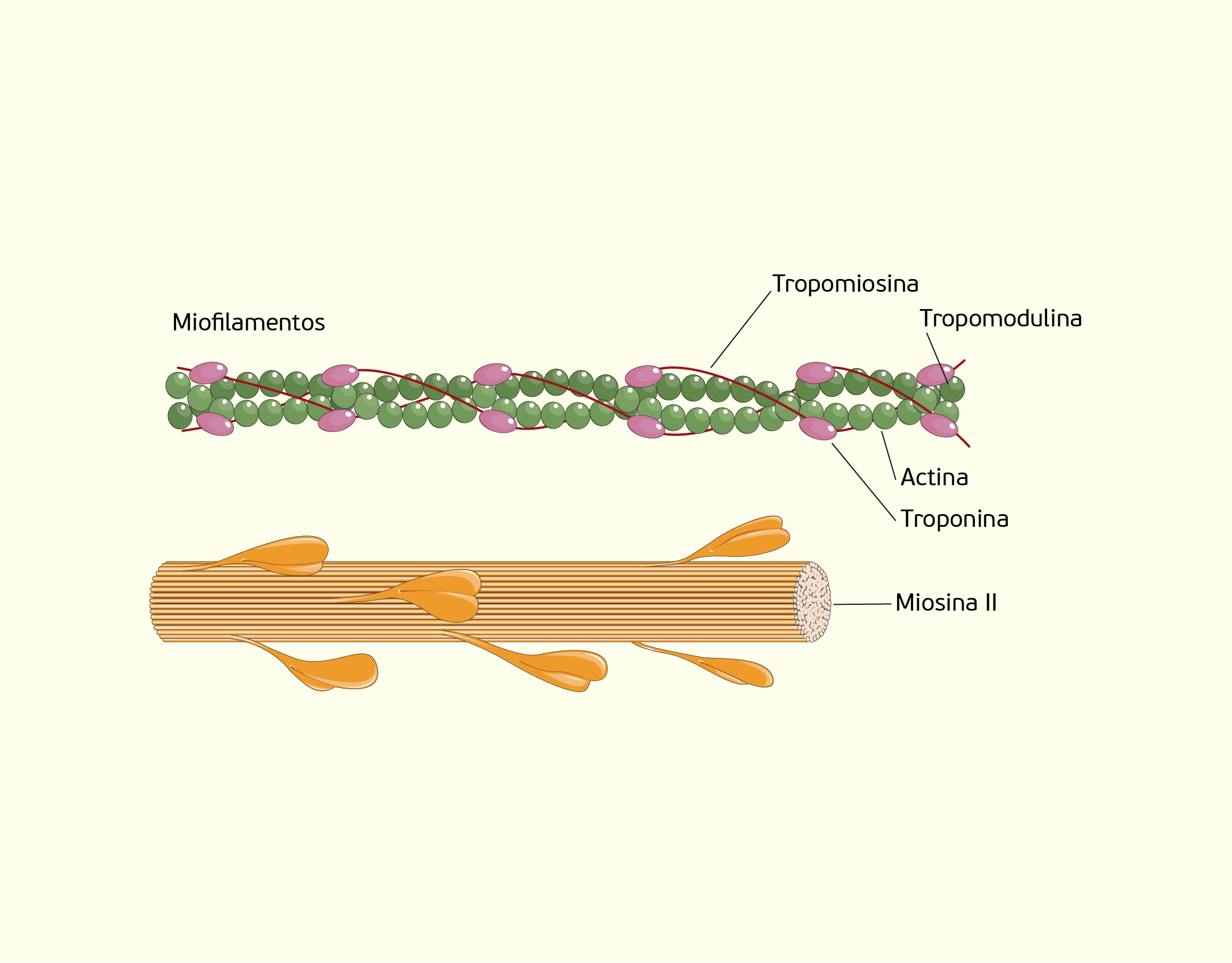
Como já dissemos no decorrer deste tópico, as células do tecido muscular contêm muitos filamentos, chamados microfibrilas. As microfibrilas são formadas por filamentos grossos e finos. Os filamentos grossos são formados por inúmeras moléculas de miosina que, por sua vez, são formada por subunidades, que se assemelham à tacos de golfe (Figura 2.27). As extremidades são entrelaçadas, com duas cabeças globulares projetando-se para fora, essas cabeças formam as pontes cruzadas entre os filamentos finos e grossos. Cada ponte cruzada possui um local de ligação para actina, além disso, possui atividade ATPásica (atividade de decomposição do ATP), é neste local que ocorre a hidrólise do ATP para fornecer energia para a contração (SHERWOOD, 2011; JUNQUEIRA; CARNEIRO, 2013).
22729 Representação das fibras miosina e actina que compõem as microfibrilas Fonte: Gartner; Hiatt (2007, p. 168).
Os filamentos finos são formados por actina, tropomiosina e troponina. A actina é o componente principal dos filamentos finos e apresenta-se como um polímero, formado por dois cordões de monômeros globulares, torcidos um sobre o outro. Cada molécula de actina possui sítios de ligação para acoplamento com uma ponte cruzada de miosina e a ligação das moléculas de miosina e actina nas pontes cruzadas resulta em uma contração. As moléculas de tropomiosina são semelhantes à cordões ligados, ponta a ponta, no sulco da espiral da cadeia de actina. Essa localização da tropomiosina impede a ligação entre a actina e a miosina nas pontes cruzadas e, desta forma, bloqueia a contração. A troponina é um complexo formado por três unidades de polipeptídeos, uma unidade liga-se à tropomiosina, outra à actina e outra pode unir-se ao cálcio (Ca2+) (SHERWOOD, 2011; JUNQUEIRA; CARNEIRO, 2013).
Contração Muscular
Os íons de cálcio estão relacionados com a contração muscular. Quando os níveis de cálcio são reduzidos no sarcoplasma, o músculo relaxa. O retículo sarcoplasmático é uma rede de cisternas do retículo endoplasmático que armazena e regula o fluxo de cálcio. Quando a membrana do retículo sarcoplasmático é despolarizada (as cargas elétricas ao redor da membrana são, momentaneamente, invertidas) por um estímulo do sistema nervoso, em resposta, os canais de cálcio da membrana do retículo sarcoplasmático abrem-se e ocorre a difusão dos íons de cálcio, que atuam na troponina, e possibilitam a ligação entre a actina e a miosina (JUNQUEIRA; CARNEIRO, 2013).
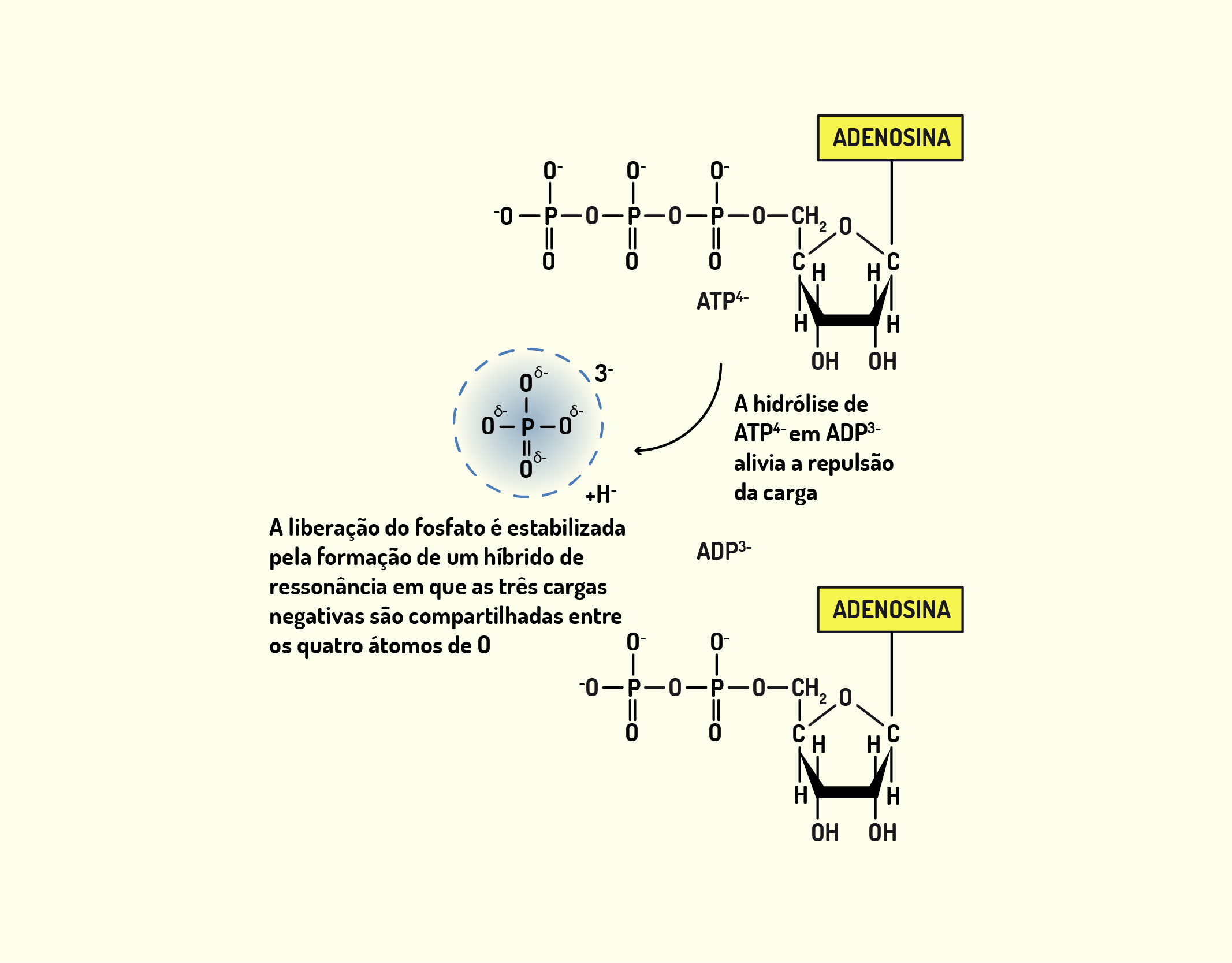
Durante o ciclo de contração, os filamentos finos e grossos do sarcômero conservam seus comprimentos originais. Quando os filamentos deslizam-se uns sobre os outros ocorre a contração, porque diminui o tamanho dos sarcômeros. Quando ocorre a disponibilidade de cálcio, estes se ligam a troponina, mudando a sua conformação, o que permite a ligação entre a actina e a miosina. Na interação entre miosina e actina, a miosina utiliza a actina como co-fator para atacar a molécula de ATP e liberar energia. Como resultado desta interação, o ATP libera ADP, Pi (fosfato inorgânico) e energia. Com isso, ocorre uma deformação da cabeça da miosina, aumentando a curvatura da mesma e esse movimento da cabeça da miosina desloca o filamento de actina, o que faz com ela deslize sobre a miosina, provocando a contração. A ponte de actinamiosina se desfaz quando a miosina une-se à uma nova molécula de ATP, o que faz com que a cabeça da miosina volte à sua posição original. Para que uma contração muscular aconteça são necessários milhares de ciclos de formação de pontes de actinamiosina (JUNQUEIRA; CARNEIRO, 2013).
Inervação: a contração das fibras esqueléticas é comandada pelos nervos motores do sistema nervoso. O local onde a porção final do nervo tem contato com a fibra muscular é chamado placa motora ou junção neuromuscular e, nesta junção, o sarcolema forma dobras juncionais. Assim, quando uma fibra do nervo recebe um impulso nervoso, a porção final do nervo libera uma substância química, mais especificamente, um neurotransmissor chamado acetilcolina. Esse neurotransmissor liga-se à estruturas específicas, localizadas no sarcolema das dobras juncionais, chamadas de receptores. A interação entre o neurotransmissor e o receptor torna a sarcolema mais permeável aos íons de sódio (Na+), resultando na despolarização do sarcolema. A despolarização é uma alteração de cargas elétricas entre o lado interno e externo do sarcolema. O interior da célula é mais negativo em relação ao meio externo, a alteração da permeabilidade do sarcolema, permite a entrada de íons positivos, como os íons de sódio (Na+), e altera a diferença de cargas entre o meio interno e externo da célula. Sendo assim, os íons de sódio difundindo-se para o lado interno do sarcolema (que é a membrana da célula muscular) diminuem as cargas negativas, causando a despolarização do sarcolema. Essa despolarização propaga-se pela fibra muscular e penetra na profundidade da fibra, através do retículo sarcoplasmático, que causa a liberação cálcio, iniciando o ciclo de contração. Assim que a despolarização acaba, o cálcio é transportado novamente para o retículo sarcoplasmático e a fibra muscular relaxa (JUNQUEIRA; CARNEIRO, 2013).
Músculo cardíaco: as células que formam o músculo cardíaco são alongadas e ramificadas, onde junções intercelulares prendem umas às outras. Essas células também apresentam estrias transversais, como o músculo esquelético, no entanto, contêm de um a dois núcleos localizados centralmente (lembrando que as células do músculo esquelético são multinucleadas e localizados perifericamente). A estrutura e função das proteínas das células cardíacas são semelhantes ao músculo esquelético, no entanto, seus componentes não são tão bem organizados como no mesmo. O músculo cardíaco apresenta linhas transversais que aparecem em intervalos irregulares ao longo da célula, essa linhas correspondem aos discos intercalares, que é uma estrutura especializada que interconecta as células do músculo cardíaco. Os discos intercalares apresentam junções de membrana, como os desmossomos, zônula de adesão e as junções comunicantes. Os desmossomos unem as células, impedindo que se separem durante a atividade cardíaca e os discos intercalares encontram-se nas junções comunicantes, responsáveis pelas passagens de íons entre as células musculares. Essa passagem de íons faz com que a contração se propague como uma onda de uma célula para outra, desta forma, do ponto de vista funcional, essa passagem de íons faz com que as células do músculo cardíaco comportem-se como um sincício, porque a contração é propagada de uma célula para outra, coordenadamente (SHERWOOD, 2011; JUNQUEIRA; CARNEIRO, 2013).
A estrutura e a função das proteínas contráteis do músculo cardíaco são semelhantes ao do músculo esquelético, contudo, seus elementos como o retículo sarcoplasmático não são tão bem organizados. Outra característica do músculo cardíaco é que a existência de células musculares cardíacas modificadas são acopladas às outras células do órgão, fazendo com que as contrações dos átrios e dos ventrículos sejam em determinada sequência, o que é de fundamental importância para a geração e condução do estímulo (JUNQUEIRA; CARNEIRO, 2013).
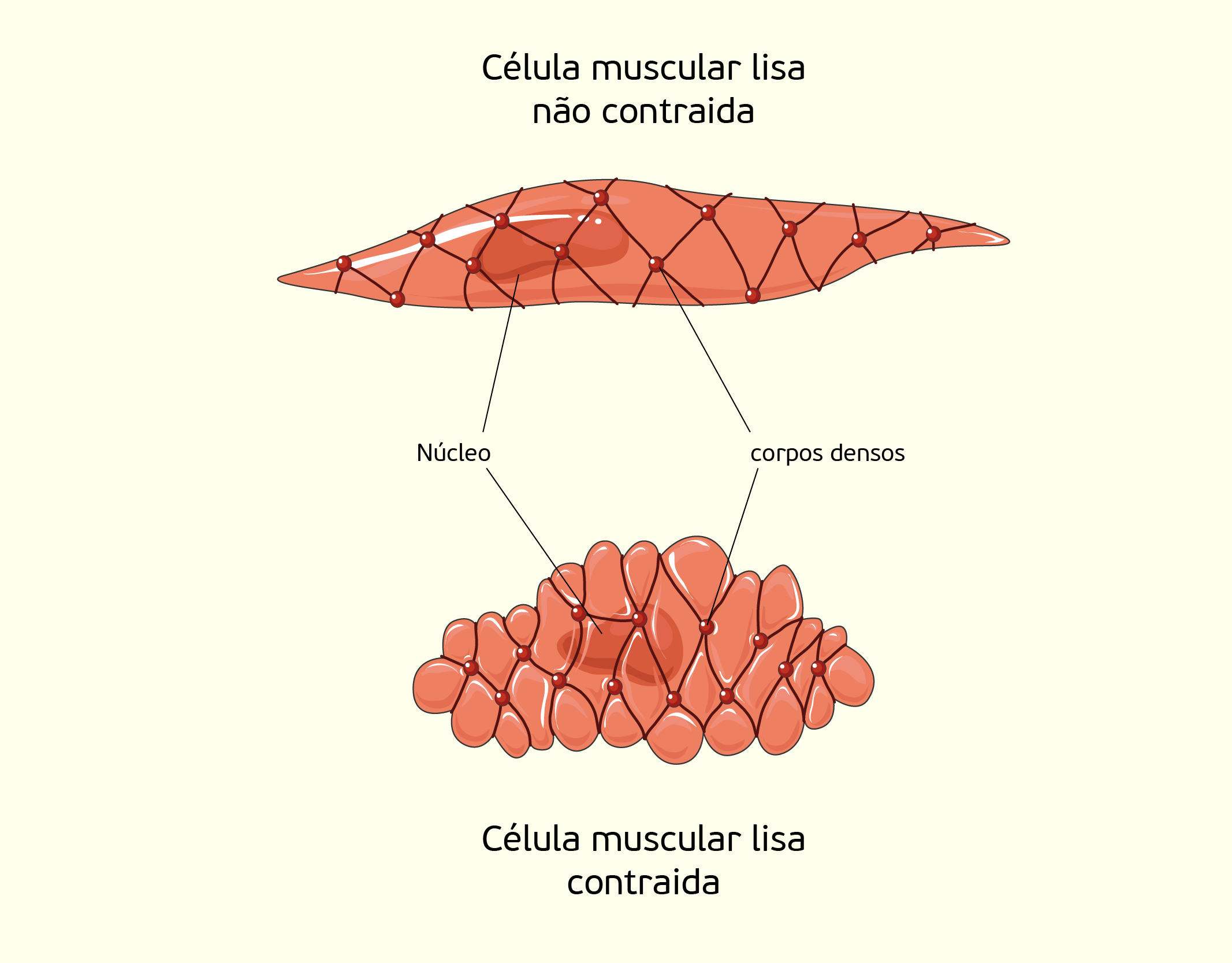
Músculo liso: as células que formam o músculo liso são mais espessas no centro e vão se afinando nas extremidades, além de possuírem um único núcleo central (Figura 2.28). Estas células são mantidas unidas por uma rede de fibras reticulares (JUNQUEIRA; CARNEIRO, 2013).
22829 Figura tridimensional de um músculo liso Fonte: Junqueira; Carneiro (2013, p. 196).
O arranjo destas células se dá de tal forma que uma contração de algumas células se transforma em uma contração do músculo inteiro. Embora o mecanismo molecular de contração do músculo liso seja o deslizamento da miosina e actina, o mecanismo de contração do músculo liso é diferente. No sarcoplasma, não há a presença de sarcômeros e nem de troponina. Nos outros tecidos musculares, a miosina é do tipo I que se mantém estirada e constitui o filamento grosso, já, as células cardíacas contém a miosina do tipo II, cujas moléculas encontram-se enroladilhadas, exceto quando são combinadas com um radical fosfato, quando ocorre o estiramento. Quando ocorre um estímulo do sistema nervoso autônomo (divisão no sistema nervoso que atua no controle de atividades involuntárias do nosso corpo), os íons de cálcio difundem-se para o meio extracelular e combinam-se com uma proteína chamada calmodulina, formando o complexo calmodulina- Ca2+ que ativa a enzima da miosina. Essa enzima adiciona fosfato à molécula de miosina II, assim que a miosina fosforilada se distende, tomando a forma filamentosa, o que descobre os sítios que têm atividade ATPásica e se combinam com a actina. A combinação entre a miosina e a actina libera ATP e promove a deformação da cabeça das moléculas de miosina II, resultando no deslizamento da actina e de miosina, da mesma forma que ocorre nos músculos esquelético e cardíaco. A actina e a miosina II estão ligadas à filamentos intermediários, que se ligam à corpos densos na membrana da célula, provocando a contração da célula como um todo (Figura 2.29) (JUNQUEIRA, CARNEIRO, 2013).
22929 Representação de uma célula do músculo lisa e contraída Fonte: Junqueira; Carneiro (2013, p. 197).
Reflita
Quando um animal ou um ser humano morre, suas articulações ficam enrijecidas. Esses enrijecimento é chamado de rigor mortis (rigidez cadavérica). Como as células estão mortas, elas não conseguem produzir o ATP, a ponte actinamiosina não é desfeita. Recorde que no processo de contração a miosina associa-se à actina, que a utiliza como co-fator para atacar o ATP e conseguir energia. Essa ponte só é desfeita quando a miosina se une novamente à uma molécula de ATP. Desta forma, as cabeças da miosina ficam unidas ao sítio ativo das moléculas de actina. Isso explica a rigidez muscular conhecida com rigor mortis, que pode ser utilizado para determinar o tempo de morte.
Atividades
Entre os diversos tecidos do corpo humano, pode-se citar os tecidos muscular e cartilaginoso. O tecido muscular, é responsável pelos movimentos do corpo, já o tecido cartilaginoso desempenha a função de suporte de tecidos moles, entre outras funções. Considerando os tecidos muscular e cartilaginoso analise as afirmativas abaixo e, julgue o que for CORRETO:
- O tecido muscular é formado por células chamadas condrócitos, que ocupam cavidades chamadas lacunas.
Os condrócitos são células do tecido cartilaginoso, já, as células que formam o tecido muscular são chamadas fibras musculares.
- As microfibrilas são formadas por filamentos grossos e finos.
As microfibrilas são formadas por filamentos grossos e finos. Os filamentos grossos são formados por inúmeras moléculas de miosina e os filamentos finos são formados por actina, tropomiosina e troponina.
- As células do tecido cartilaginoso recebem nutrientes através dos vasos sanguíneos deste tecido.
A cartilagem é desprovida de vasos sanguíneos, linfáticos e nervos. Desta forma, as células do tecido cartilaginoso recebem nutrientes através de vasos sanguíneos do tecido conjuntivo que as envolve, sendo esta região chamada de pericôndrio.
- A membrana das células musculares é chamada de sarcoplasma.
A membrana das células musculares é chamada de sarcolema, já, o citoplasma de sarcoplasma.
- Os íons relacionados com a contração do tecido muscular esquelético são os íons cloreto.
Os íons de cálcio estão relacionados com a contração muscular. Durante o processo de contração, em resposta ao estímulo do sistema nervoso, os canais de cálcio da membrana do retículo sarcoplasmático abrem-se e ocorre a difusão dos íons de cálcio, que atuam na troponina e possibilitam a ligação entre a actina e a miosina
Indicação de leitura
Nome do livro: Biologia celular e molecular
Editora: Guanabara-Koogan
Autor: Luiz Carlos Uchoa Junqueira e José Carneiro
ISBN: 978-85-277-2078-6
O livro Biologia celular e molecular dos autores Junqueira e Carneiro aborda, de forma bem clara e objetiva, todas as estruturas e componentes celulares, tema esse abordado no decorrer do conteúdo desta unidade. Neste livro você também poderá encontrar mais detalhes sobre os processos de divisão celular como a meiose e a mitose. Esperamos que essa indicação contribua com seus estudos. Boa leitura!